Bekanntmachung einer Stellungnahme der Strahlenschutzkommission (Geschlechtsspezifische Unterschiede der Strahlenempfindlichkeit - epidemiologische, klinische und biologische Studien)
Zurück zur Teilliste Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit
Geschlechtsspezifische Unterschiede der Strahlenempfindlichkeit – epidemiologische, klinische und biologische Studien
Stellungnahme der Strahlenschutzkommission
Verabschiedet in der 236. Sitzung der Strahlenschutzkommission am 17./18. September 2009
Inhaltsverzeichnis
1 | Einleitung | |||
2 | Epidemiologische Studien | |||
3 | Klinische Erkenntnisse nach Strahlentherapie | |||
4 | Strahlenbiologische Studien | |||
5 | Zusammenfassende Stellungnahme | |||
Literatur | ||||
Anhang 1 | Zusammenfassung der strahlenepidemiologischen Erkenntnisse | |||
1 | Einschätzung durch andere nationale und internationale Institutionen | |||
1.1 | BEIR VII | |||
1.2 | UNSCEAR | |||
1.3 | ICRP | |||
2 | Einzelstudien | |||
2.1 | Bericht zur Mortalität der Atombombenüberlebenden – solide Tumoren (Preston et al. 2003) | |||
2.2 | Bericht zur Inzidenz von soliden Tumoren bei den Atombombenüberlebenden (Preston et al. 2007) | |||
2.2.1 | Alle Tumoren zusammen | |||
2.2.2 | Magen | |||
2.2.3 | Kolon | |||
2.2.4 | Leber | |||
2.2.5 | Lunge | |||
2.2.6 | Blase | |||
2.2.7 | Schilddrüse | |||
2.2.8 | Andere Organe | |||
2.3 | Gepoolte Studie zum Auftreten von strahleninduziertem | |||
2.4 | Studie zum Auftreten von Schilddrüsenkarzinomen nach | |||
2.5 | Studien an Kindern und Jugendlichen aus Bryansk zum Auftreten | |||
2.6 | Lungenkrebs nach Behandlung von Morbus Hodgkin und Vergleich | |||
2.7 | Lungenkrebs bei Mayak- | |||
2.8 | Organspezifische Inzidenz und Mortalität nach zerebraler | |||
2.9 | Studie zur Mortalität durch Leukämie unter den | |||
2.10 | Studie zu Leukämien an Arbeitern von vier US Kernwaffen- | |||
2.11 | Weitere Studien zur strahleninduzierten Leukämie | |||
ANHANG 2: | Zusammenfassung der klinischen Erkenntnisse | |||
1 | Einleitung | |||
2 | Effektivität der Tumortherapie | |||
3 | Unerwünschte Folgen der Strahlentherapie | |||
4 | Zweitmalignome nach Strahlentherapie | |||
Literatur | ||||
Anhang 3: | Zusammenfassung der biologischen Erkenntnisse | |||
1 | Genetische und molekulare Basis der Geschlechtsbestimmung | |||
1.1 | Geschlechtschromosomen beim Menschen | |||
1.2 | Y- | |||
1.3 | Geschlechtsdifferenzierung | |||
1.4 | Inaktivierung des X- | |||
1.5 | Epigenetische Regulation der Inaktivierung des X- | |||
1.6 | Genomische Prägung (Genomic Imprinting) | |||
2 | Problemstellung und mögliche experimentelle Ansätze | |||
3 | Tiermodelle | |||
4 | Zelluläre Antworten auf Strahlung | |||
4.1 | Quantifizierung der Genexpression (Microarray- | |||
4.2 | Epigenetische Regulation der Genexpression | |||
4.3 | Signaltransduktion | |||
4.4 | DNA- | |||
4.5 | Zellproliferation und Apoptose | |||
5 | Bystander- | |||
6 | Hormonelle Einflüsse | |||
Literatur | ||||
- 1
- Einleitung
Die Internationale Strahlenschutzkommission (International Commission on Radiological Protection – ICRP) hat sich auch in ihren neuesten Empfehlungen dafür ausgesprochen, die Berechnung der effektiven Dosis trotz möglicherweise bestehender geschlechtsspezifischer Unterschiede bei den strahleninduzierten Risiken für Mann und Frau auf die gleiche Weise durchzuführen [ICRP 07]. Zwar befürwortet die ICRP geschlechts- und sogar altersspezifische Ansätze zur retrospektiven individuellen Risikoabschätzung nach externer oder interner Exposition mit ionisierender Strahlung, für die Zwecke des Strahlenschutzes besteht sie jedoch auf einer einheitlichen Berechnung der effektiven Dosis. Dementsprechend stellen die von der ICRP eingeführten Gewebewichtungsfaktoren (wT) über das Alter und das Geschlecht gemittelte Werte dar. Dies gilt auch für die weibliche und männliche Brust sowie die Gonaden. Die ICRP begründet ihr Vorgehen unter anderem mit den großen Unsicherheiten bei der Berechnung der Gewebewichtungsfaktoren und mit möglichen diskriminierenden Auswirkungen, falls geschlechtsspezifische Unterschiede bei der Berechnung von Risiken gemacht würden.
Andere nationale und internationale Institutionen betonen jedoch mögliche geschlechtsspezifische Unterschiede. So werden zum Beispiel im aktuellsten Bericht des National Research Council (NRC) der USA sowohl für solide Tumoren als auch für Leukämien mit einer für die amerikanische Bevölkerung typischen Altersverteilung für Männer und Frauen unterschiedliche zusätzliche Fälle nach Exposition mit ionisierender Strahlung errechnet [NRC 06]. Auch die wissenschaftliche Kommission der Vereinten Nationen zur Wirkung atomarer Strahlung (United Nations Scientific Committee on the Effects of Atomic Radiation – UNSCEAR) geht davon aus, dass sowohl das zusätzliche relative als auch das zusätzliche absolute Risiko für alle soliden Tumoren zusammen für Frauen etwa einen Faktor 2 höher ist als für Männer [UNSC 08].
Epidemiologische Studien belegen eine für Frauen signifikant niedrigere spontane Tumorinzidenz als für Männer. So werden bei SEER*) (1975-2005) alterskorrigiert und für alle Krebsarten zusammen für Frauen 403 und für Männer 519 Fälle pro 100 000 Personen [Rie 08] angegeben. Bezieht man sich auf einzelne Krebserkrankungen, so sind bestimmte Tumorentitäten bei Männern häufiger als bei Frauen (wie z.B. Leberkrebs, Plattenepithelkarzinome und Lymphome), während bei Frauen Meningiome und Schilddrüsentumoren häufiger auftreten als bei Männern. Es ist ungeklärt, ob die Ursachen für geschlechtsspezifische Unterschiede in der spontanen Tumorinzidenz durch genetische und/oder hormonelle Faktoren begründet sind und welchen Einfluss berufliche Faktoren und Verhalten („life style“) haben.
Hinweise auf Unterschiede in der Strahlenempfindlichkeit männlicher und weiblicher Gewebe gibt es aus klinischen Studien, in denen die frühen bzw. späten Nebenwirkungen nach Strahlen- und kombinierter Strahlen-/Chemotherapie geschlechtsspezifisch aufgeschlüsselt wurden [Bor 09]. Allerdings gibt es bisher nur wenige Studien, die systematisch mögliche geschlechtsspezifische Unterschiede in der Sensitivität gegenüber ionisierender Strahlung analysiert haben. Hingegen wurden in einer Vielzahl epidemiologischer Studien geschlechtsspezifische Unterschiede in der strahleninduzierten Tumorinzidenz und -mortalität analysiert. Dabei kommt den Studien an den Atombombenüberlebenden (Life Span Study, LSS), an den Betroffenen von Tschernobyl und an Kollektiven, die therapeutischer Strahlung ausgesetzt waren, hohe Bedeutung zu (siehe Kapitel 2, sowie Anhang 1 und 2). Die Ergebnisse dieser Studien bezüglich geschlechtsspezifischer Unterschiede sind allerdings häufig an der Grenze der Signifikanz, wobei der Modus der Berechnung einen wichtigen Einfluss hat, und teilweise widersprechen sich die Ergebnisse verschiedener Studien. Signifikante Unterschiede werden jedoch für die durch solare Strahlung verursachte Inzidenz von Nicht-Melanom-Krebserkrankungen sowie die altersstandardisierte Mortalität von malignen Melanomen der Haut beobachtet, die bei Männern signifikant höher sind als bei Frauen [SSK 08].
Um geschlechtsspezifische Unterschiede in der Strahlenempfindlichkeit gesichert nachzuweisen, sind Studien sowohl an geeigneten Zell- wie auch an Tiermodellen sehr wichtig. Nachweislich geeignete Modelle können dann verwendet werden, um die biologischen und molekularen Grundlagen der postulierten geschlechtsspezifischen Strahlenreaktionen aufzuklären (siehe Übersicht bei [Bor 09]). Es gibt kaum systematische Studien über die potentiellen molekularen und zellulären Grundlagen geschlechtsspezifischer Strahlenreaktionen. Das langfristige Ziel sollte sein, nachzuweisen, ob es statistisch signifikante geschlechtsspezifische Unterschiede in der Strahlenempfindlichkeit nicht nur auf zellulärer, sondern insbesondere auch auf der Ebene von Organismen, d. h. beim Menschen und in geeigneten Tiermodellen, gibt. Auf der Grundlage von eindeutig bewiesenen geschlechtsspezifischen Unterschieden im Tiermodell sollten sich danach Analysen über die möglichen zellulären und molekularen Grundlagen der postulierten geschlechtsspezifischen Unterschiede in der Strahlenempfindlichkeit beim Menschen anschließen.
- 2
- Epidemiologische Studien
UNSCEAR kam im UNSCEAR-2000-Bericht [UNSC 00] nach einer Literaturanalyse zu dem Schluss, dass das absolute zusätzliche Risiko für das Auftreten von soliden Tumoren nach Exposition mit ionisierender Strahlung für Frauen höher ist als für Männer. Im neuen UNSCEAR-2006-Bericht wird dieses Thema nur am Rande gestreift [UNSC 08]. Doch auch hier kommen die Autoren des Berichts zu dem Schluss, dass sowohl das zusätzliche relative als auch das zusätzliche absolute Risiko für alle soliden Tumoren zusammen für Frauen etwa um einen Faktor 2 höher sei als für Männer.
Im Wesentlichen basieren diese Einschätzungen auf Auswertungen der Daten der Atombombenüberlebenden von Hiroshima und Nagasaki. Im kürzlich erschienenen Bericht zur Inzidenz von Tumorerkrankungen [Pre 07] bei den Atombombenüberlebenden, der einen Follow-up von 1958 bis 1998 einschließt, finden die Autoren - wenn alle soliden Tumoren außer denen bei geschlechtsspezifischen Organen zusammengefasst werden - höhere Werte für das zusätzliche relative Risko (excess relative risk, ERR1) für Frauen als für Männer. Die Werte für das zusätzliche absolute Risko (excess absolute risk, EAR) sind für Männer und Frauen jedoch nicht signifikant verschieden. Allerdings treten zum Teil geschlechtsspezifisch unterschiedliche ERR- und EAR-Werte auf, wenn Tumorhäufigkeiten bei bestimmten Organen separat ausgewertet werden: beispielsweise sind bei Frauen die ERR-Werte für Krebserkrankungen des Magens (signifikant), der Lunge (signifikant), der Blase und der Schilddrüse größer als bei Männern, die für Krebserkrankungen des Kolons und der Leber dagegen kleiner. Analog sind bei Frauen die EAR-Werte für Lunge und Schilddrüse (signifikant) größer als bei Männern, die für Kolon (signifikant), Leber (signifikant) und Blase dagegen kleiner. Für andere Tumorarten konnten auf Grund der geringen Anzahl an Fällen in der Kohorte der Atombombenüberlebenden keine ERR- oder EAR-Werte abgeleitet werden.
Im aktuellsten Bericht zur Mortalität der Atombombenüberlebenden, der einen Follow-up von 1950 bis 1997 einschließt [Pre 03], ergibt sich, dass das zusätzliche relative Risiko (ERR) für Krebserkrankungen bei Frauen deutlich höher ist als bei Männern. Dagegen zeigt das zusätzliche absolute Risiko (EAR) keine wesentlichen Unterschiede. Preston und Mitarbeiter erklären dies mit den für Männer und Frauen unterschiedlichen Spontanraten für Tumoren.
In einer Studie zum Auftreten von Schilddüsenkrebs kommen Ron und Mitarbeiter [Ron 95] nach zusammenfassender Auswertung von 7 Einzelstudien zu dem Schluss, dass sich für Frauen ein um etwa den Faktor 2 höherer ERR-Wert ergibt als für Männer und dass dieser Unterschied jedoch nicht signifikant ist. Da die Spontanrate für das Auftreten von Schilddrüsenkrebs bei Frauen ebenfalls höher ist, ist auch der EAR-Wert für Frauen höher als für Männer. Dieses Ergebnis ist mit dem von Preston und Mitarbeitern kompatibel [Pre 07]. Ron und Mitarbeiter betonen jedoch auch, dass die entsprechenden Ergebnisse der Einzelstudien sich zum Teil deutlich widersprechen und dass sich in einigen Studien auch höhere ERR-Werte bei Männern als bei Frauen ergeben. Jacob und Mitarbeiter [Jac 06] fanden bei Kindern und Jugendlichen aus der Ukraine und Weißrussland nach dem Unfall von Tschernobyl um den Faktor 3,8 niedrigere ERR-Werte für Mädchen im Vergleich zu Jungen, was auch als ein Widerspruch zu den LSS-Daten der Atombombenüberlebenden erscheint. Wenn jedoch die ERR-Werte des Auftretens von Schilddrüsentumoren in der LSS getrennt für Überlebende, die bei den Atombombenexplosionen jünger als 15 Jahre alt waren, herangezogen werden, ergibt sich ein Verhältnis von Männern zu Frauen (M/F) von 2,9 (siehe Tabelle A17 im Anhang 1), was mit den Ergebnissen von Jacob und Mitarbeitern kompatibel ist. Auch Ivanov und Mitarbeiter fanden für Mädchen mit einem Alter bei Exposition kleiner 9 Jahre, die nach dem Unfall von Tschernobyl exponiert wurden, kleinere Werte für das zusätzliche relative Risiko als für Jungen, wobei dieser Unterschied nicht signifikant war [Iva 06].
In einer anderen Studie fanden Gilbert und Mitarbeiter nach der Strahlentherapie von Patienten mit Morbus Hodgkin bei der Inzidenz von Lungenkrebs für Männer einen etwa viermal höheren ERR-Wert als für Frauen, wobei dieser Unterschied nicht statistisch signifikant war [Gil 03[. Dieses Ergebnis steht im Widerspruch zu dem, was aus der LSS abgeleitet wurde (wo für Frauen höhere ERR-Werte als für Männer gefunden wurden, s.o.). Gilbert und Mitarbeiter führten dies unter anderem auf unterschiedliche Lungenkrebs-Spontanraten (z.B. auf die niedrigen Spontanraten in Japan), unterschiedliche Dosiswerte, Fraktionierung, Dosisraten, und einen möglicherweise nicht ausreichend berücksichtigten Einfluss von Rauchen und Chemotherapie zurück.
In einer Studie an Mayak-Arbeiten zur Lungenkrebs-Mortalität wurde ein signifikant um den Faktor 4 höheres zusätzliches relatives Risiko für Frauen als für Männer bei interner Exposition beobachtet [Gil 04], was mit den Ergebnissen der LSS kompatibel ist. Für das zusätzliche absolute Risiko ergab sich für Frauen dagegen ein um den Faktor 0,43 geringerer Wert als für Männer.
Travis und Mitarbeiter untersuchten das Krebsrisiko nach einer Langzeit-Exposition auf Grund inkorporierter Radionuklide, die beim Zerfall Alphateilchen aussenden, und zogen dazu Kohorten aus Schweden, Dänemark und den USA heran [Tra 03]. In keiner der untersuchten Kohorten konnten sie bei Männern und Frauen signifikante Unterschiede im relativen Risiko nachweisen, wenn alle soliden Tumore zusammen ausgewertet wurden. Allerdings fanden sie bei Männern ein nicht signifikant erhöhtes Risiko von Non-Hodgkin- Lymphomen und von Krebs des Rektums, bei Frauen dagegen von Basalzell- und Plattenepithelkarzinomen der Haut, multiplen Myelomen, Kolonkrebs, Lungenkrebs und Schilddrüsenkrebs. Keiner dieser geschlechtsspezifischen Unterschiede war statistisch signifikant. Es zeigte sich allerdings ein deutlicher Unterschied, wenn in den dänisch/schwedischen Daten getrennt weibliche (Gebärmutterhals, Gebärmutter, Eierstöcke) und männliche Geschlechtsorgane (Prostata, Hoden) ausgewertet wurden. Dann ergab sich für das RR für Frauen ein Wert von 1,1, für Männer dagegen ein Wert von 4,7 [Tra. 03].
In Bezug auf Leukämie stammen die belastbarsten Informationen zu möglichen geschlechtsspezifischen Unterschieden von den Daten der Atombombenüberlebenden. Basierend auf dem zusätzlichen absoluten Risiko ergibt sich dort, dass Frauen ein signifikant niedrigeres Risiko als Männer aufweisen (Frauen/Männer (F/M)-Verhältnis: 0,6 (90%-KI: 0,4; 0,8)). Der neueste UNSCEAR-Bericht [UNSC 08] bestätigt dieses Ergebnis. Im BEIR-VII-Bericht wird von niedrigeren relativen und absoluten Risiken für Frauen als für Männer ausgegangen. Allerdings sind die Konfidenzbereiche der Schätzungen groß. In einer Studie an Arbeitern von vier US Kernwaffen-Produktionsstätten und einer Atomschiffswerft finden die Autoren für Frauen ein ähnliches signifikant niedrigeres zusätzliches relatives Risiko (F/M-Verhältnis: 0,42 (95%-KI: 0,23; 0,71)) [Sch 07], was im Widerspruch steht zur jüngsten Analyse von UNSCEAR, die basierend auf den Daten der Atombombenüberlebenden für das ERR keine geschlechtsspezifischen Unterschiede sieht [UNSC 08]. Studien an der am Techa Fluss im Südural lebenden Bevölkerung [Kre 05] sowie an Beschäftigten in Mayak [Shi 03] deuten im Gegensatz dazu auf höhere zusätzliche relative Risiken für die Frau hin (Techa Fluss: ERR für Frauen etwa 70% höher als für Männer; Mayak: F/M-Verhältnis 1,7 (90%-KI: 0,23; 11,2)). Diese Ergebnisse sind jedoch statistisch nicht signifikant. In allen anderen im Rahmen dieser Empfehlung betrachteten Studien zum Leukämierisiko nach Exposition mit ionisierender Strahlung (s. Anhang 1) konnten keine Aussagen zu möglichen geschlechtsspezifischen Unterschieden gefunden werden.
3 Klinische Erkenntnisse nach Strahlentherapie
Unterschiedliche Strahlenempfindlichkeit von Männern und Frauen könnte sich im Rahmen der Strahlentherapie auf das Ansprechen des Tumors und die Lokalkontrolle (d.h. die Verhinderung von Rezidiven am Ort des Primärtumors) auswirken, aber auch auf unerwünschte frühe und späte Nebenwirkungen, einschließlich der Induktion von Zweitmalignomen. Trotz der Wichtigkeit der Thematik, auch im Hinblick auf Therapieentscheidungen, gibt es nur sehr wenige systematische Untersuchungen zum Einfluss des Geschlechts auf diese Endpunkte. Hinsichtlich Lokalkontrolle und Überleben zeigt sich bei einigen Tumorarten konsistent bei Frauen eine günstigere Entwicklung als bei Männern (Übersicht bei [Bor 09]), die zumindest teilweise auf eine höhere Wirksamkeit der Chemotherapie bei Frauen zurückgeführt werden kann [Sin 05]. Systematische Vergleiche unter Einbeziehung der Modalitäten einer Strahlentherapie sind dagegen nicht verfügbar. Auch Daten hinsichtlich unerwünschter Nebenwirkungen der Strahlentherapie bei Männern und Frauen sind kaum verfügbar. Die wenigen vorliegenden Ergebnisse lassen keine Schlüsse auf geschlechtsspezifische Unterschiede in der Strahlenempfindlichkeit zu. Hinsichtlich des Auftretens von Zweittumoren bei Überlebenden von Krebserkrankungen werden zunehmend Ergebnisse großer, auf klinische und epidemiologische Tumorregister gestützter Studien mit mehreren 10 000 Patienten verfügbar. Während diese Studien Zweittumorrisiken routinemäßig für Männer und Frauen getrennt bestimmen und im Normalfall – soweit möglich – Vergleiche der Risiken zwischen Patienten, die bei der Ersterkrankung bestrahlt wurden, und solchen, die nicht bestrahlt wurden, durchführen, fragen nur wenige der Studien nach möglichen geschlechtsspezifischen Unterschieden beim Strahleneffekt. Konsistent beobachtet wird ein erhöhtes Risiko für Brustkrebs nach Bestrahlung im Bereich des Brustkorbs bei weiblichen Kindern und Jugendlichen, z.B. im Rahmen einer Therapie von Morbus Hodgkin [Bha 02] oder Non-Hodgkin-Lymphomen [Blu 08]. In diesen Studien war das Zweittumor-Risiko für Frauen auch erhöht, wenn Brustkrebserkrankungen ausgeschlossen wurden.
4 Strahlenbiologische Studien
In epidemiologischen Studien sind viele Hinweise erbracht worden, dass es geschlechtsspezifische Strahlensensibilität beim Menschen geben mag. Für eine sichere Beweisführung sind jedoch zusätzlich biologische Studien notwendig. Für diese biologischen Studien müssen geeignete Versuchsmodelle eingesetzt werden, mit denen bei ausreichendem Versuchsumfang die postulierte geschlechtsspezifische Strahlensensibilität eindeutig nachgewiesen werden kann. Außer einer Regulation durch genetische und epigenetische Mechanismen können auch andere Faktoren, insbesondere Hormone und Unterschiede in der Lebensweise, einen Einfluss haben. Tiermodelle, mit denen die Tumorinzidenz und ggf. auch andere Endpunkte als Indikatoren für Strahlensensibilität unter physiologischen Bedingungen analysiert und quantifiziert werden können, erscheinen daher geeigneter als Zellmodelle für den Nachweis einer geschlechtsspezifischen Strahlenempfindlichkeit.
Bisherige Experimente an Tiermodellen bestätigen und erweitern die Evidenz der epidemiologischen Studien für das Auftreten geschlechtsspezifischer Unterschiede in der Strahlenempfindlichkeit. Zum Beispiel zeigten weibliche Mäuse eine wesentlich höhere Inzidenz von Lymphomen des Thymus sowie eine höhere Inzidenz von Osteosarkomen nach Behandlung mit Th-227 als männliche Mäuse [Mül 78]. Hingegen zeigten männliche Mäuse nach chronischer UVB-Behandlung und Behandlung mit chemischen Karzinogenen eine höhere Tumorinzidenz als weibliche Mäuse [Tho 07, Huf 91]. Um Informationen über die Mechanismen zu erhalten, die der postulierten geschlechtsspezifischen Strahlensensibilität zugrunde liegen, wurden neben den Tiermodellen auch Zellmodelle verwendet. Dazu gehören humane periphere Blutzellen von gesunden Probanden sowie Zelllinien oder primäre Zellen ausgewählter Organe der Mausmodelle, die für den Nachweis der geschlechtsspezifischen Strahlensensibilität eingesetzt wurden. Neben funktionellen Assays zur Untersuchung der zellulären Antworten auf Bestrahlung, wie z.B. für DNA-Schädigung und -Reparatur, Mutationen und Zelltod (Apoptose) (zur Übersicht siehe [Bor 09]) kamen gesamtgenomische Screening-Verfahren zum Einsatz, wie z.B. Microarrays zur Analyse der Genexpression (Quantifizierung der Transkript-Mengen) [Mea 08, Whi 03], sowie verschiedene Techniken zur Analyse epigenetischer Regulationsmechanismen (Methylierungsmuster von DNA, Modifikationsmuster von Histonen, Expression von microRNAs) [Kov 04, Pog 04, Sil 04].
Bei den Microarray-Analysen der strahleninduzierten Genexpression fanden sich eine Reihe von geschlechtsspezifisch exprimierten Genen, allerdings waren keine Korrelationen zu entsprechenden zellulären Phänotypen nachzuweisen, die als Indikatoren für Strahlenempfindlichkeit gelten, wie z.B. Apoptose oder DNA-Schädigung und -Reparatur. Ebensowenig waren Korrelationen zu den in den epidemiologischen Studien postulierten geschlechtsspezifisch strahleninduzierten Tumoren nachzuweisen, was vermutlich aber auch dadurch begründet ist, dass für die Experimente völlig unterschiedliche Versuchssysteme verwendet wurden. Daher sind alle diese Ansätze nur begrenzt aussagekräftig.
In den vergangenen Jahren wurden primär durch die zahlreichen Arbeiten der Gruppe von O. Kovalchuk neue experimentelle Ansätze entwickelt. Diese Gruppe erbrachte vielfache Belege dafür, dass der Bystander-Effekt (in dieser Ausprägung früher von anderen Autoren als „abskopaler Effekt“ bezeichnet), der in vivo in Mäusen und Ratten nach lokaler Bestrahlung des Kopfes in der unbestrahlten Milz nachgewiesen werden konnte, geschlechtsspezifische Unterschiede zeigt. Diese geschlechtsspezifischen Unterschiede zeigten sich bei Parametern wie DNA-Brüchen und Apoptose, vor allem aber bei epigenetischen Parametern wie DNA-Methylierung, Histon-Modifikationen und Expressionsmustern und -mengen von microRNAs [Iln 09, Kot 06, Kot 07, Kot 08]. Durch Mäuse, deren Gonaden nach der Geburt entfernt worden waren, konnte der eindeutige Nachweis erbracht werden, dass Hormone einen deutlichen Einfluss auf die geschlechtsspezifische Strahlenempfindlichkeit haben [Kot 08].
Unter Verwendung der etablierten Tiermodelle sind somit in Zukunft große, interdisziplinäre Studien möglich. Diese sollten erlauben, in umfassenden Versuchsansätzen mit männlichen und weiblichen Tieren, bei denen wichtige hormonelle Unterschiede kontrolliert bzw. reguliert werden können, geschlechtsspezifische Unterschiede von den molekularen über die zellulären Prozesse bis hin zur Tumorinzidenz und -mortalität zu analysieren.
5 Zusammenfassende Stellungnahme
Die epidemiologischen Studien, in denen Risikokoeffizienten getrennt für Frauen und Männer angegeben werden, liefern widersprüchliche Ergebnisse bezüglich der geschlechtsspezifischen Strahlenempfindlichkeit. Die Studien an den Atombombenüberlebenden zeigen – sowohl für Mortalität als auch für Inzidenz – für alle soliden Tumorarten zusammen signifikant höhere ERR-Werte für Frauen als für Männer. Da Frauen jedoch geringere Spontanraten als Männer aufweisen, sind die entsprechenden EAR-Werte für Frauen und Männer ähnlich. Dies gilt jedoch nur, solange geschlechtsspezifische Organe nicht berücksichtigt werden. Werden alle Organe inklusive der geschlechtsspezifischen gemeinsam ausgewertet, bleibt bei den Inzidenzdaten ein signifikant höherer EAR-Wert für Frauen bestehen, während hinsichtlich der Mortalität die EAR-Werte vergleichbar sind. Es muss allerdings betont werden, dass die wenigen epidemiologischen Studien, die sich mit dem strahleninduzierten Auftreten desselben Tumortyps in unterschiedlichen Kollektiven beschäftigen, in manchen Fällen widersprüchliche Ergebnisse liefern. Beispielsweise ergeben die Daten der Atombombenüberlebenden ein höheres zusätzliches absolutes Risiko für Frauen als für Männer bei Schilddrüsenkarzinomen, andere Studien finden jedoch genau das Gegenteil.
Bei der Berechnung der Risikokoeffizienten und der Gewebewichtungsfaktoren ist es nötig, die an den Atombombenüberlebenden gewonnenen Risikoschätzungen auf andere Populationen zu übertragen. Dies ist sowohl auf der Basis eines ERR-Models (multiplikativ) als auch eines EAR-Models (additiv) möglich. Da häufig nicht klar ist, welches Modell das bessere ist, verwendet die ICRP für die meisten Tumorarten den Mittelwert der Risiken aus ERR und EAR. Für die weibliche Brust und das Knochenmark werden nur die EAR-Werte verwendet, für die Schilddrüse und die Haut nur die ERR-Werte, für die Lunge wird der EAR-Wert mit 0,3, der ERR-Wert mit 0,7 gewichtet. Auf Grund der mit den abgeleiteten Detrimentwerten verbundenen Unsicherheiten hält es die ICRP nicht für notwendig, mögliche geschlechtsspezifische Unterschiede zu berücksichtigen.
Hinsichtlich der strahlenbiologischen Experimente ist zusammenfassend zu sagen, dass für verschiedene Endpunkte (z.B. Tumorentstehung in experimentellen Modellen, Veränderungen der Genexpression und der epigenetischen Muster nach Bestrahlung) geschlechtsspezifische Unterschiede beschrieben wurden, dass aber die wenigsten der Beobachtungen bislang reproduziert werden konnten. Auch ist für die meisten der Beobachtungen bislang völlig unklar, ob sich Unterschiede in diesen Endpunkten auf das Tumorrisiko auswirken. So wurde mit Hilfe moderner Screening-Verfahren eine große Zahl von Genen identifiziert, die in Reaktion auf Strahlung bei den Geschlechtern unterschiedlich exprimiert werden, jedoch ist ihr Einfluss auf die Strahlenempfindlichkeit meist unbekannt. Weiterhin sprechen viele Befunde in Mäusen dafür, dass neben direkten strahleninduzierten Effekten auch lange persistierende Bystander-Effekte eine Rolle spielen, die durch Geschlechtshormone beeinflusst und durch epigenetische Prozesse verursacht sind. Auch hier sind die molekularen Mechanismen dieser Effekte weitgehend unbekannt. Basierend auf der derzeitigen Datenlage können in Zukunft gezielt Versuchsansätze entwickelt werden, um geschlechtsspezifische molekulare und zelluläre Reaktionen auf Strahlenexpositionen in ihren molekularen Mechanismen zu verstehen. Langfristig ist eine Korrelation zu Tumorinzidenzen, die im selben Tiermodell bestimmt wurden, anzustreben.
Stellungnahme der Strahlenschutzkommission (SSK):
- 1.
- Epidemiologische, klinische und biologischen Studien haben zwar Hinweise auf, jedoch keine eindeutigen Beweise für mögliche geschlechtsspezifische Unterschiede in der Strahlenempfindlichkeit (Endpunkte: Mortalität und Krebs) erbracht. Daher besteht Forschungsbedarf, um mögliche geschlechtsspezifische Unterschiede in der strahleninduzierten Inzidenz von Tumoren in einzelnen Organen und in der Strahlenempfindlichkeit von Gesamtorganismen sicher nachzuweisen und auf der Grundlage der molekularen, zellulären und geweblichen Reaktionen auf Bestrahlung zu verstehen. Zukünftige Studien sollten schon in der Konzeptionsphase im Hinblick auf spätere Evaluierung geschlechtsspezifischer Unterschiede im Strahlenrisiko optimiert werden.
- 2.
- Auf Grund der beschriebenen begrenzten Datenlage sowohl bei den klinischen Studien als auch den biologischen Experimenten und der zum Teil widersprüchlichen Ergebnisse der epidemiologischen Studien sind nach Ansicht der SSK gegenwärtig keine eindeutigen Aussagen zu geschlechtsspezifischen Unterschieden in der Strahlenempfindlichkeit möglich. Die zum Teil in den Stellungnahmen anderer nationaler und internationaler Institutionen zum Ausdruck gebrachte Sicherheit der Aussagen zu einer generell erhöhten Strahlenempfindlichkeit der Frau kann die SSK nach Analyse der Einzelstudien nicht nachvollziehen.
- 3.
- Nach sorgfältiger Analyse kommt die SSK daher zu dem Schluss, dass die Berücksichtigung möglicher geschlechtsspezifischer Unterschiede bei der Strahlenempfindlichkeit im Strahlenschutz gegenwärtig nicht notwendig ist.Literatur
[Bha 02]
Bhatia, S.; Sklar, C.: Second cancers in survivors of childhood cancer. Nat Rev Cancer 2(2):124-
32, 2002 [Blu 08]
Bluhm, E. C.; Ronckers, C.; Hayashi, R. J.; Neglia, J. P.; Mertens, A. C.; Stovall, M.; Meadows, A. T.; Mitby, P. A.; Whitton, J. A.; Hammond, S.; Barker, J. D.; Donaldson, S. S.; Robison, L. L.; Inskip, P. D.: Cause-
specific mortality and second cancer incidence after non- Hodgkin lymphoma: a report from the Childhood Cancer Survivor Study. Blood 111(8):4014- 4021, 2008 [Bor 09]
Borgmann, K. et al.: Sex-
specific aspects of tumor therapy. Radiat Environ Biophys 48(2):115- 24, 2009 [Gil 03]
Gilbert, E. S.; Stovall, M.; Gospodarowicz, M.; van Leeuwen, F. E.; Andersson, M.; Glimelius, B.; Joensuu, T.; Lynch, C. F.; Curtis, R. E.; Holowaty, E.; Storm, H.; Pukkala, E.; van’t Veer, M. B.; Fraumeni, J. F. Jr; Boice, J. D. Jr; Clarke, E. A.; Travis, L. B.: Lung Cancer after Treatment for Hodgkin’s Disease: Focus on Radiation Effects. Radiat Res 159:161-
173, 2003 [Gil 04]
Gilbert, E. S.; Koshurnikova, N. A.; Sokolnikov, M. E.; Shilnikova, N. S.; Preston, D. L.; Ron, E.; Okatenko, P. V.; Khokhryakov, V. F.; Vasilenko, E. K.; Miller, S.; Eckerman, K.; Romanov, S. A.: Lung Cancer in Mayak Workers. Radiat Res 162:505-
516, 2004 [Huf 91]
Huff, J. et al.: Chemicals associated with site-
specific neoplasia in 1394 long- term carcinogenesis experiments in laboratory rodents. Environ Health Perspect 93:247- 270, 1991 [Iln 09]
Ilnytskyy, Y.; Koturbash, I.; Kovalchuk, O.: Radiation-
induced bystander effects in vivo are epigenetically regulated in a tissue- specific manner. Environ Mol Mutagen 50(2):105- 113, 2009 [ICRP 07]
International Commission on Radiological Protection ICRP: The 2007 Recommendations of the International Commission on Radiological Protection. ICRP Publication 103. Ann. ICRP 37(2-
4), Oxford: Pergamon Press, 2007 [Iva 06]
Ivanov, V. K.; Gorski, A. K.; Tsyb, A. F.; Maksioutov, M. A.; Tumanov, K. A.; Vlasov, O. K.: Radiation-
epidemiological studies of thyroid cancer incidence among children and adolescents in the Bryansk oblast of Russia after the Chernobyl accident (1991- 2001 follow- up period). Radiat Environ Biophys 45:9- 16, 2006 [Jac 06]
Jacob, P.; Bogdanova, T. I.; Buglova, E.; Chepurniy, M.; Demidchik, Y.; Gavrilin, Y.; Kenigsberg, J.; Meckbach, R.; Schotola, C.; Shinkarev, S.; Tronko, M. D.; Ulanovsky, A.; Vavilov, S.; Walsh, L.: Thyroid cancer risk in areas of Ukraine and Belarus affected by the Chernobyl accident. Radiat Res 165:1-
8, 2006 [Kot 06]
Koturbash, I. et al.: Irradiation induces DNA damage and modulates epigenetic effectors in distant bystander tissue in vivo. Oncogene, 25(31):4267-
4275, 2006 [Kot 07]
Koturbash, I. et al.: Role of epigenetic effectors in maintenance of the long-
term persistent bystander effect in spleen in vivo. Carcinogenesis, 28(8):1831- 1838, 2007 [Kot 08]
Koturbash, I. et al.: Radiation-
induced bystander effects in vivo are sex specific. Mutat Res 642(1- 2):28- 36, 2008 [Kov 04]
Kovalchuk, O. et al.: Dissimilar genome response to acute and chronic low-
dose radiation in male and female mice. Mutat Res. 550(1- 2):59- 72, 2004 [Kre 05]
Krestinina, L. Yu.; Preston, D. L.; Ostroumova, E. V.; Degteva, M. O.; Ron, E.; Vyushkova, O.V.; Startsev, N. V.; Kossenko, M. M.; Akleyev, A. V.: Protracted radiation exposure and cancer mortality in the Techa River Cohort. Radiat Res 164:602-
611, 2005 [Mea 08]
Meadows, S. K. et al.: Gene expression signatures of radiation response are specific, durable and accurate in mice and humans. PLoS ONE 3(4): e1912, 2008
[Mül 78]
Müller, W. A. et al.: Late effects after incorporation of the short-
lived alpha- emitters 224Ra and 227Th in mice. Health Phys 35(1):33- 55, 1978 [NCR 06]
National Research Council (NRC) of the National Academies: Health Risks from exposure to low levels of ionizing radiation – BEIR VII Phase 2. Board on Radiation Effects Research, Division on Earth and Life Studies, National Research Council of the National Academies, The National Academies Press, Washington, D.C., 2006
[Pog 04]
Pogribny, I. et al.: Dose-
dependence, sex- and tissue- specificity, and persistence of radiation- induced genomic DNA methylation changes. Biochem Biophys Res Commun 320(4):1253- 1261, 2004 [Pre 03]
Preston, D. L.; Shimizu, Y.; Pierce, D. A.; Suyama, A.; Mabuchi, K.: Studies of mortality of atomic bomb survivors. Report 13: Solid cancer and noncancer disease mortality: 1950-
1997. Radiat Res 160:381- 407, 2003 [Pre 07]
Preston, D. L.; Ron, E.; Tokuoka, S.; Funamoto, S.; Nishi, N.; Soda, M.; Mabuchi, K.; Kodama, K.: Solid cancer incidence in atomic bomb survivors: 1958-
1998. Radiat Res 168:1- 64, 2007 [Rie 08]
Ries, L. A. G. et al.: SEER Cancer Statistics Review, 1975 - 2005. National Cancer Institute: Bethesda, MD. 2008
[Ron 95]
Ron, E.; Lubin, J. H.; Shore, R. E.: Mabuchi, K.; Modan, B.; Pottern, L. M.; Schneider, A. B.; Tucker, M. A.; Boice, J. D. Jr: Thyroid cancer after exposure to external radiation: a pooled analyis of seven studies, Radiat Res 141(3):259-
277, 1995 [Sch 07]
Schubauer-
Berigan, M. K.; Daniels, R. D.; Fleming, D. A.; Markey, A. M.; Couch, J. R.; Ahrenholtz, S. H.; Burphy, J. S.; Anderson, J. L.; Tseng, C.: Risk of chronic myeloid and acute leukemia mortality after exposure to ionizing radiation among workers at four U.S. nuclear weapons facilities and a nuclear naval shipyard. Radiat Res 167:222- 232, 2007 [Shi 03]
Shilnikova, N. S.; Preston, D. L.; Ron, E.; Gilbert, E. S.; Vassilenko, E. K.; Romanov, S. A.; Kuznetsova, I. S.; Sokolnikov, M. E.; Okatenko, P. V.; Kreslov, V. V.; Koshurnikova, N. A.: Cancer mortality risk among workers at the Mayak Nuclear Complex. Radiat Res 159:787-
798, 2003 [Sil 04]
Silasi, G. et al.: Selective brain responses to acute and chronic low-
dose X- ray irradiation in males and females. Biochem Biophys Res Commun 325(4):1223- 1235, 2004 [Sin 05]
Singh, S.; Parulekar, W.; Murray, N.; Feld, R.; Evans, W. K.; Tu, D. and Shepherd, F. A.: Influence of sex on toxicity and treatment outcome in small-
cell lung cancer. J Clin Oncol 23:850- 856, 2005 [SSK 08]
Strahlenschutzkommission (SSK): Einfluss der natürlichen Strahlen-
exposition auf die Krebsentstehung in Deutschland. Veröffentlichungen der Strahlenschutzkommission, Band 62, 215- 313. Stellungnahme der Strahlenschutzkommission mit wissenschaftlicher Begründung. H. Hoffmann GmbH - Fachverlag, Berlin, 2008 [Tho 07]
Thomas-
Ahner, J. M. et al.: Gender differences in UVB- induced skin carcinogenesis, inflammation, and DNA damage. Cancer Res 67(7):3468- 3474, 2007 [Tra 03]
Travis, L. B.; Hauptmann, M.; Knudson Gaul, L.; Storm, H. H.; Goldman, M. B.; Nyberg, U.; Berger, E.; Janower, M. L.; Hall, P.; Monson, R. R.; Holm, L. E.; Land, C. E.; Schottenfeld, D.; Boice, J. D. Jr; Andersson, M.: Site-
specific cancer incidence and mortality after cerebral angiography with radioactive thorotrast. Radiat Res 160:691- 706, 2003 [UNSC 00]
United Nations Scientific Committee on the Effects of Atomic Radiation: Sources and Effects of ionizing radiation: UNSCEAR 2000 Report to the General Assembly, United Nations, New York, 2000
[UNSC 08]
United Nations Scientific Committee on the Effects of Atomic Radiation: Effects of ionizing radiation – UNSCEAR 2006 Report, Vol I. Report to the General Assembly, with scientific annexes A and B. United Nations sales publications. United Nations, New York, 2008
[Whi 03]
Whitney, A. R. et al.: Individuality and variation in gene expression patterns in human blood. Proc Natl Acad Sci USA 100(4):1896-
1901, 2003
ANHANG 1:
Zusammenfassung der strahlenepidemiologischen Erkenntnisse
1 Einschätzung durch andere nationale und internationale Institutionen
In den letzten Jahren wurde von einigen übergeordneten wissenschaftlichen Institutionen Berichte zum Risiko durch Exposition mit ionisierender Strahlung verfasst. Dazu zählen der BEIR-VII-Bericht des National Research Council (NRC) der USA [NRC 06], der UNSCEAR-2000- und der UNSCEAR-2006-Bericht [UNSC 00, 08] sowie die neuen Empfehlungen der ICRP [ICRP 07]. In diesen Berichten wird diskutiert dass die Strahlenempfindlichkeit von menschlichem Gewebe geschlechtsspezifische Unterschiede aufweisen könnte.
- 1.1
- BEIR VII
Im aktuellsten Bericht, Biological Effects of Ionizing Radiation BEIR VII, des National Research Council (NCR) der USA werden sowohl für solide Tumoren als auch für Leukämie für Männer und Frauen mit einer für die amerikanische Bevölkerung typischen Altersverteilung unterschiedliche zusätzliche Fälle nach Exposition mit ionisierender Strahlung errechnet (Tabelle A1) [NRC 06].
Tab. A1: Abgeschätzte zusätzliche Fälle (Inzidenz bzw. Mortalität) in der amerikanischen Bevölkerung bei Exposition von 100 000 Personen mit einer Dosis von 0,1 Gy („Life-time attributable risk“); in Klammern: 95 %-Konfidenzintervalle, [NRC 06].
Solide Tumoren | Leukämie | |||
Männer | Frauen | Männer | Frauen | |
Inzidenz | 800 (400, 1 600) | 1 300 (690, 2 500) | 100 (30, 300) | 70 (20, 250) |
Mortalität | 410 (200, 830) | 610 (300, 1 200) | 70 (20, 220) | 50 (10, 190) |
Tabelle A1 zeigt, dass nach Überzeugung des NCR von 100 000 amerikanischen Frauen etwa 1 300 nach einer Exposition mit 0,1 Gy an einem soliden Tumor erkranken, dagegen von 100 000 amerikanischen Männern nur etwa 800. Zwar sind diese Unterschiede nicht statistisch signifikant (die entsprechenden 95% Konfidenzintervalle überlappen), doch können sie als Ausdruck möglicher geschlechtsspezifischer Unterschiede der Strahlenempfindlichkeit beim Menschen aufgefasst werden. Im Gegensatz zu den soliden Tumoren scheint dagegen das Leukämierisiko von Männern gegenüber dem von Frauen etwas erhöht zu sein.
Diese Zahlen basieren auf der Auswertung und Bewertung von verschiedenen Kohorten, deren Mitgliedern ionisierender Strahlung ausgesetzt waren, wobei die LSS-Kohorte (LSS: Life Span Study) der Atombombenüberlebenden von Hiroshima und Nagasaki den wichtigsten Beitrag liefert. Die Gesundheitsdaten aus diesen Kohorten werden mit zwei unterschiedlichen Modellen – dem Modell des zusätzlichen relativen Risikos (Excess Relative Risk: ERR, Gleichung 1) und dem des zusätzlichen absoluten Risikos (Excess Absolute Risk: EAR, Gleichung 2) berechnet.
| (1) |
| (2) |
Dabei ist l(c,s,a,b) die Spontanrate, die ohne eine zusätzliche Dosis ionisierender Strahlung auftritt, c ein bei der Auswertung der LSS-Daten nötiger Stadtparameter (Hiroshima oder Nagasaki), s der Geschlechtsparameter (weiblich, männlich), a das Alter bei Erkrankung bzw. Tod, b das Geburtsjahr, e das Alter bei Exposition und d die Dosis. Die Größe bs gibt im jeweiligen Modell die Steigung in einem linearen Dosis-Wirkungs-Modell an, während ERR(e,a) bzw. EAR(e,a) Wichtungsfaktoren für den Einfluss des Alters bei Exposition, e, und des Alters bei Erkrankung, a, darstellen.
ERR(s,d) und EAR(s,d) sind dosisabhängige Größen. Nimmt man eine lineare Dosis-Wirkungs-Beziehung ohne Schwelle an (LNT-Hypothese), so gibt der (geschlechtsabhängige) Risikokoeffizient βS die Erhöhung des absoluten Risikos pro Dosis an:
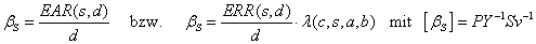
PY: Personenjahre
Um die Strahlenempfindlichkeit in Bezug auf einen untersuchten Endpunkt zu quantifizieren, werden in epidemiologischen Studien häufig die Größen
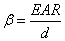 bzw.
bzw. 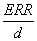
herangezogen (d.h. die Steigung der Dosis-Risiko-Beziehung). In vielen dieser Studien (auch in den LSS-Studien) werden hierfür etwas missverständlich und im strengen Sinn nicht korrekt die Ausdrücke EAR/Sv (oder EAR/Gy) bzw. ERR/Sv (oder ERR/Gy) verwendet. Um den direkten Vergleich mit den zitierten Studien nicht zu erschweren, wird im Folgenden diese Notation beibehalten.
Im BEIR-VII-Bericht werden aus den Daten der Atombombenüberlebenden für alle soliden Tumoren (ohne Schilddrüsentumoren und nicht-melanozytären Hautkrebs), normiert auf ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 60 Jahren, die in Tabelle A2 aufgelisteten Werte angegeben. Tabelle A2 verdeutlicht, dass nach Überzeugung des NRC aus den Daten der Atombombenüberlebenden deutliche Unterschiede der Strahlensensibilität von Mann und Frau abgeleitet werden können. Diese Unterschiede erwähnt der BEIR-VII-Bericht auch für verschiedene Organe, mit der Ausnahme von Brust und Schilddrüse wieder auf der Basis von Auswertungen der LSS-Kohorte (Tabelle A3).
Tab. A2: Aus den Atombombenüberlebenden abgeleitete Werte für ERR/Sv und EAR/Sv (Inzidenz bzw. Mortalität) für alle soliden Tumoren, für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 60 Jahren; KI: Konfidenzintervall, [NRC 06].
ERR/Sv (95%- | EAR pro Sv und 104 Personenjahre (95%- | |||
Männer | Frauen | Männer | Frauen | |
Inzidenz | 0,33 (0,24; 0,47) | 0,57 (0,44; 0,74) | 22 (15; 30) | 28 (22; 36) |
Mortalität | 0,23 (0,15; 0,36) | 0,47 (0,34; 0,65) | 11 (7,5; 17) | 13 (9,8; 18) |
Tab. A3: Aus der LSS-Kohorte abgeleitete organspezifische Werte für ERR und EAR (Inzidenz und Mortalität) für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 60 Jahren; KI: Konfidenzintervall, [NRC 06]; Brust: basierend auf [Pre 02]; Schilddrüse: basierend auf [Ron 95] und [NIH 2003].
Lokalisation der soliden Tumoren | ERR/Sv (95%- | EAR pro Sv und 104 Personenjahre (95%- | ||
Männer | Frauen | Männer | Frauen | |
Magen | 0,21 (0,11; 0,40) | 0,48 (0,31; 0,73) | 4,9 (2,7; 8,9) | 4,9 (3,2; 7,3) |
Kolon | 0,63 (0,37; 1,1) | 0,43 (0,19; 0,96) | 3,2 (1,8; 5,6) | 1,6 (0,8; 3,2) |
Leber | 0,32 (0,16; 0,64) | 0,32 (0,10; 1,0) | 2,2 (1,9; 5,3) | 1,0 (0,4; 2,5) |
Lunge | 0,32 (0,15; 0,70) | 1,40 (0,94; 2,1) | 2,3 (1,1; 5,0) | 3,4 (2,3; 4,9) |
Brust | - | 0,51 (0,28; 0,83) | 9,4 (6,7; 13,3) | |
Prostata | 0,12 (< 0; 0,69) | - | 0,11 (<0; 1,0) | - |
Uterus | - | 0,055 (< 0; 0,22) | - | 1,2 (<0; 2,6) |
Ovarien | - | 0,38 (0,10; 1,4) | - | 0,7 (0,2; 2,1) |
Blase | 0,50 (0,18; 1,4) | 1,65 (0,69; 4,0) | 1,2 (0,4; 3,7) | 0,75 (0,3; 1,7) |
Andere solide Tumoren | 0,27 (0,15; 0,50) | 0,45 (0,27; 0,75) | 6,2 (3,8; 7,3) | 4,8 (3,2; 7,3) |
Schilddrüse | 0,53 (0,14; 2,0) | 1,05 (0,28; 3,9) | ||
Mit der Ausnahme von Kolon und Leber sind die ERR-Werte für die Organe von Frauen generell höher als die für dieselben Organe von Männern. Allerdings wird im BEIR-VII-Bericht betont, dass die statistischen Unsicherheiten, die mit den Werten verbunden sind, oft hoch sind. Interessanterweise scheint der Trend höherer Werte für Frauen als für Männer für die EAR-Werte nicht so stark ausgeprägt zu sein (siehe Diskussion unten).
- 1.2
- UNSCEAR
Nach Literaturanalyse kommt UNSCEAR zu dem Schluss, dass das absolute zusätzliche Risiko für das Auftreten von soliden Tumoren nach Exposition mit ionisierender Strahlung für Frauen höher ist als für Männer („Although differences in the absolute risk of tumour induction with sex are not large and vary with site, for most solid cancers the absolute risk is higher in women than in men“ (Par. 74, S. 11 [UNSC 00])). Das zusätzliche Lebenszeitrisiko nach einer Exposition mit 1 Sv ergibt sich gemäß UNSCEAR zu 9% für Männer und 13% für Frauen, wobei die Unsicherheiten dieser Abschätzungen etwa einen Faktor 2 betragen. Für Leukämie wird dagegen kein geschlechtsspezifischer Unterschied angegeben, und es ergibt sich ein Wert von 1% nach einer Exposition mit 1 Sv (Par. 84, 85, Seite 13 [UNSC 00]).
Basierend auf der Analyse der Atombombenüberlebenden werden zudem geschlechtsspezifische Unterschiede auch für verschiedene Organe gefunden (Tabelle A4), die darauf hindeuten, dass das entsprechende zusätzliche relative Risiko für Frauen etwa einen Faktor 2 höher ist als das für Männer.
Es sei allerdings darauf hingewiesen, dass das Frau-zu-Mann (F/M)-Verhältnis für das Kolon (2,1) nicht mit dem von Preston et al. [Pre 07] für die Atombombenüberlebenden angegebenen Wert von 0,5 übereinstimmt (siehe Kapitel 2.2.3). Ähnliches gilt für den Wert für die Blase (0,8 in Tabelle A4, dagegen 3,1 in Kapitel 2.2.6).
Tab. A4: Aus Untersuchungen an den Atombombenüberlebenden (Age-at-exposure Model; Inzidenzdaten) abgeleitete Werte für ERR/Sv für ein Alter bei Exposition von 30 Jahren (Tabelle 31 in [UNSC 00]).
Lokalisation der soliden Tumoren | Männer | Frauen | Frau/Mann |
Alle Organe | 0,38 | 0,79 | 2,1 |
Speiseröhre | 0,41 | 0,84 | 2,1 |
Magen | 0,29 | 0,60 | 2,1 |
Kolon | 0,46 | 0,95 | 2,1 |
Leber | 0,58 | 0,58 | 1,0 |
Lunge | 0,50 | 2,18 | 4,3 |
Brust | 0 | 1,55 | - |
Blase | 1,18 | 0,98 | 0,8 |
Andere Organe | 0,47 | 0,28 | 0,6 |
Im kürzlich erschienenen neuen UNSCEAR-2006-Report werden detailliert die Ergebnisse verschiedenster Studien zum strahleninduzierten Krebsrisiko in verschiedensten Organen einschließlich Leukämie zusammengestellt (Tabellen 19–44 in [UNSC 08]). Dabei werden die aus der LSS erzielten Ergebnisse sowohl im Hinblick auf Mortalität als auch auf Inzidenz getrennt für Männer und Frauen zitiert (meist basierend auf [Pre 03] und [Pre 07]. Die Autoren von [UNSC 08] kommen zu dem Schluss, dass sowohl das zusätzliche relative als auch das zusätzliche absolute Risiko für alle soliden Tumoren zusammen für Frauen etwa einen Faktor 2 höher ist als für Männer (… both the ERR and the EAR for total solid cancers are somewhat higher (by about a factor of 2) for women than for men.“ ([UNSC 08], Par. 136, Seite 56). Für Lungenkrebs erwähnen sie explizit, dass das ERR/Sv für Frauen größer als das für Männer ist, das EAR/Sv jedoch ähnlich („… the ERR per unit dose (Sv-1) was larger for females than for males, but the EARs were similar for both sexes.“ ([UNSC 08], Par. 273, Seite 80)), (vgl. auch Kapitel 2.2.5). Schließlich wird im UNSCEAR-Bericht von einem höheren spontanen Auftreten von Schilddrüsentumoren bei Frauen als bei Männern berichtet und explizit erwähnt, dass der BEIR-VII-Bericht eine Erhöhung auch für strahleninduzierte Schilddrüsentumoren bei Frauen abschätzt. Trotzdem kommt UNSCEAR zu dem Schluss, dass die Rolle des Geschlechts bei der Abschätzung des strahleninduzierten Risikos nicht klar ist („… the role of sex in determining radiation risk is unclear. …“ ([UNSC 08], Par. 467, Seite 108)), wohl auch deswegen, da die zu diesem Thema durchgeführten Studien sich zum Teil widersprechen („… The effect of sex is not consistent in all studies.“ ([UNSC 08], Par. 467, Seite 108)), (siehe auch Kapitel 2.3, Tabelle A17)).
- 1.3
- ICRP
Die Internationale Strahlenschutzkommission (International Commission on Radiological Protection – ICRP) hat sich auch in ihren neuesten Empfehlungen (ICRP-Bericht-103) dafür ausgesprochen, die Berechnung der effektiven Dosis trotz möglicherweise bestehender geschlechtsspezifischer Unterschiede bei den strahleninduzierten Risiken für Mann und Frau auf die gleiche Weise durchzuführen [ICRP 07]. Zwar befürwortet die ICRP für bestimmte Zwecke geschlechts- und sogar altersspezifische Ansätze (so werden in Kürze Referenz-Voxelphantome für Mann und Frau eingeführt, die zur Berechnung individueller Dosen nach externer oder interner Exposition mit ionisierender Strahlung eingesetzt werden können, und es werden auch Voxelphantome für Kinder unterschiedlichen Alters entwickelt), für die Zwecke des Strahlenschutzes befürwortet sie trotzdem eine einheitliche Berechnung der effektiven Dosis („… for the purpose of radiological protection it is useful to apply a single value of effective dose for both sexes.“ ([ICRP 072], par. 132, Seite 69)). Dementsprechend stellen die von der ICRP eingeführten Gewebewichtungsfaktoren (wT) über das Alter und das Geschlecht gemittelte Werte dar. Dies gilt auch für die weibliche und männliche Brust sowie die Gonaden. Diese Wichtung soll jedoch nur für den Strahlenschutz gelten und ist für die Abschätzung individueller Risiken nach einer Exposition mit ionisierender Strahlung nicht geeignet („This averaging implies that the application of this approach is restricted to the determination of effective dose E in radiological protection and, in particular, cannot be used for the assessment of individual risk.“ ([ICRP 07], par. 132, Seite 69)). Die ICRP betont jedoch, dass natürlich für den Zweck einer retrospektiven Risikoabschätzung geschlechtsspezifische Daten herangezogen werden können („However, for the purposes of retrospective evaluation of radiation-related risks … it is appropriate to use sex- and age-specific data and calculate sex- and age-specific risks.“ ([ICRP 07], par. 33, Seite 42)). Die ICRP begründet ihr Vorgehen unter anderem mit den großen Unsicherheiten, die mit der Berechnung der effektiven Dosis behaftet sind („In view of the uncertainties … the Commission considers it appropriate for radiological protection purposes to use age- and sex-averaged tissue weighting factors and numerical risks.“ ([ICRP 07], par. 33, Seite 42)) und mit möglichen diskriminierenden Elementen, falls geschlechtsspezifische Unterschiede bei der Berechnung von Risiken gemacht würden („Moreover, this obviates the requirement for sex- and age-specific radiological protection criteria which could prove unnecessarily discriminatory.“ ([ICRP 07], par. 33, Seite 42)).
Trotz dieser Vorbehalte werden in den neuen Empfehlungen der ICRP geschlechtsspezifische Detrimentwerte auch organabhängig angegeben ([ICRP 07], Tab. A.4.18, Seite 209), wobei die ICRP noch einmal betont, dass diese im gegenwärtigen Strahlenschutzkonzept der ICRP keine Rolle spielen („… These sex-specific values for detriment do not have specific functions in the Commission’s system of radiological protection …” ([ICRP 07], Tab. A.4.18, Seite 209)). Die für die Bevölkerung von der ICRP abgeleiteten relativen geschlechtsspezifischen Werte sind in Tabelle A5 für verschiedene Organe aufgelistet und den von der ICRP berechneten mittleren relativen Detrimentwerten ([ICRP 07], Tab. A.4.1, Seite 179) sowie den tatsächlich zur Berechnung der effektiven Dosis verwendeten wT-Werte gegenübergestellt.
Auffällig ist beispielsweise beim Kolon der um etwa den Faktor 3 höhere Wert für Männer als für Frauen, der auf das EAR-Modell zurückzuführen ist (siehe Kapitel 2.2.3). Der tatsächlich verwendete wT-Wert ist dann 0,12. Ähnliches gilt auch für die Leber (siehe Kapitel 2.2.4), wobei sich die ICRP hier für einen wT-Wert von 0,04 entschieden hat, der etwa dem geschlechtsspezifischen Mittelwert entspricht. Im Falle der Schilddrüse ist das relative Detriment für Frauen deutlich höher als für Männer. Hier basiert die ICRP ihre Schätzungen im Wesentlichen auf die Ergebnisse der Studie von Ron et al. (Kapitel 2.3). Verglichen mit dem geschlechtsspezifischen Mittelwert von 0,022 vergrößert die ICRP hier etwas willkürlich das Gewicht und verwendet für wT einen doppelt so hohen Wert von 0,04. Die ICRP begründet dies damit, dass sie damit die besonders hohe Strahlenempfindlichkeit der kindlichen Schilddrüse berücksichtigen will. Für alle anderen Organe mit Ausnahme der Lunge sind die relativen Detrimentwerte für Männer höher als die für Frauen. Zu beachten ist dabei, dass für Frauen 27% des Detriments von der Brust und den Ovarien herrührt. Die Risiken für Speicheldrüsen- und Gehirntumoren wurden von der ICRP – obwohl aus den Daten nicht separat ableitbar – etwas höher eingeschätzt als die für Tumoren in den 14 verbleibenden Gewebearten. Den wT-Werten für Speicheldrüse und Gehirn wurde daher separat jeweils ein Wert von 0,01 zugewiesen.
Tab. A5: Geschlechtsabhängige Werte für das Detriment für die Bevölkerung (Alter 0 – 85 Jahre bei Exposition) (Tabelle A.4.18 aus [ICRP 07]), entsprechende Mittelwerte (Tabelle A.4.1. aus [ICRP 07]) und tatsächlich von der ICRP eingeführte Gewebewichtungsfaktoren (Tabelle 3 aus [ICRP 07]).
Organ | Männer | Frauen | ICRP Mittel | Tatsächlicher ICRP- |
Speiseröhre | 0,026 | 0,021 | 0,023 | 0,04 |
Magen | 0,12 | 0,117 | 0,118 | 0,12 |
Kolon | 0,138 | 0,044 | 0,083 | 0,12 |
Leber | 0,075 | 0,026 | 0,046 | 0,04 |
Lunge | 0,124 | 0,182 | 0,157 | 0,12 |
Knochen | 0,011 | 0,008 | 0,009 | 0,01 a) |
Haut | 0,008 | 0,006 | 0,007 | 0,01 |
Brust | - | 0,240 | 0,139 | 0,12 |
Ovarien | - | 0,030 | 0,017 | - |
Blase | 0,036 | 0,024 | 0,029 | 0,04 |
Schilddrüse | 0,010 | 0,031 | 0,022 | 0,04 |
Knochenmark | 0,144 | 0,080 | 0,107 | 0,12 |
Übrige Gewebe (14) | 0,256 | 0,155 | 0,198 | 0,12 |
Gonaden | 0,053 b) | 0,038 b) | 0,044 b) | 0,08 c) |
Gehirn d) | - | - | - | 0,01 |
Speicheldrüse d) | - | - | - | 0,01 |
Summe | 1,00 | 1,00 | 1,00 | 1,00 |
- a)
- Knochenoberfläche
- b)
- Erbschäden
- c)
- Erbschäden und Krebs
- d)
- war früher bei ICRP 60 unter der Kategorie „übrige Gewebe“ geführt
2 Einzelstudien
- 2.1
- Bericht zur Mortalität der Atombombenüberlebenden – solide Tumoren
(Preston et al. 2003)
In einem von Preston und Mitarbeitern veröffentlichten Bericht zur Mortalität der Atombombenüberlebenden, der einen Follow-up von 1950 bis 1997 einschließt [Pre 03], werden mögliche geschlechtsspezifische Unterschiede im strahleninduzierten Risiko diskutiert. Beispielsweise zeigt Tabelle A6, dass bei Verwendung eines Modells, in dem sowohl das Alter bei Exposition als auch das erreichte Alter berücksichtigt wird, die ERR-Werte für Frauen deutlich höher als die für Männer sind. Die entsprechenden EAR-Werte für das absolute Risiko dagegen zeigen keine wesentlichen Unterschiede.
Tab. A6: Von Preston und Mitarbeitern aus den Daten der Atombombenüberlebenden abgeleitete ERR- und EAR-Werte für alle soliden Tumoren, für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren; KI: Konfidenzintervall, [Pre 03]. * vermutlich Druckfehler in [Pre 03].
ERR/Sv (90%- | EAR pro Sv und 104 Personenjahre (90%- | |||
Männer | Frauen | Männer | Frauen | |
Mortalität | 0,35 (0,24; 0,46) | 0,59 (0,45; 0,74) | 29 (30*; 39) | 30 (24; 37) |
Dies ist laut Preston und Mitarbeitern lange bekannt („… it has long been reported that the estimated EAR/Sv depends little on sex despite the significant sex effect on the ERR …”). Sie führen diesen scheinbaren Widerspruch darauf zurück, dass die Spontanraten der Mortalität an soliden Tumoren in Japan für Frauen deutlich niedriger sind als für Männer, was hauptsächlich das zusätzliche relative Risiko beeinflusst („Clearly the relative risks are greater for women than for men (p < 0,003), but this largely serves to offset a reciprocal ratio in background rates, and there is little sex difference in the EAR“). Tabelle A7 veranschaulicht, dass diese Interpretation für einige ausgewählte Organe außer der Leber gültig ist.
In einer kurze Zeit später von Preston und Mitarbeitern veröffentlichten Analyse, in der primär der Einfluss des neuen Dosimetrie Systems DS02 auf die von den Atombombenüberlebenden abgeleiteten Risikokoeffizienten untersucht wird und die einen etwas längeren Follow-up Zeitraum von 1950 bis 2000 einschließt, wird von ähnlichen Ergebnissen berichtet [Pre 04]: für das ERR ergab sich ein signifikant von 1 verschiedenes F/M-Verhältnis von 1,9 (90%-KI: 1,4; 2,7), während sich für das EAR ein von 1 nicht signifikant unterschiedliches F/M-Verhältnis von 1,1 (90%-KI: 0,8; 1,6) ergab.
Tab. A7: ERR-Werte für alle soliden Tumoren (vgl. Tabelle A6) und entsprechende Werte für einige Organe, für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren. Die p-Werte in Spalte 4 gelten für die Nullhypothese eines F/M-Wertes von 1 (keine geschlechtsspezifischen Unterschiede). Zum Vergleich ist in Spalte 5 das M/F-Verhältnis der Spontanraten angegeben; bei Ähnlichkeit der Werte in den Spalten 4 und 5 ist davon auszugehen, dass die erhöhten ERR-Werte für Frauen auf die niedrigeren Spontaninzidenzen zurückführbar sind, und dass beim EAR nur geringe Unterschiede zwischen den Geschlechtern bestehen [Pre 03].
Lokalisation der soliden Tumoren | ERR/Sv | Spontanrate M/F | ||
Männer (M) | Frauen (F) | F/M | ||
alle soliden Tumoren | 0,347 | 0,588 | 1,7 (p = 0.01) | 1,8 |
Magen | 0,196 | 0,636 | 3,2 (p = 0.01) | 2,3 |
Lunge | 0,472 | 1,05 | 2,2 (p = 0.02) | 2,4 |
Kolon | 0,370 | 0,414 | 1,1 (p > 0.5) | 1,3 |
Leber | 0,402 | 0,400 | 1,0 (p > 0.5) | 2,1 |
andere Organe | 0,351 | 0,326 | 0,93 (p > 0.5) | 1,3 |
- 2.2
- Bericht zur Inzidenz von soliden Tumoren bei den Atombombenüberlebenden (Preston et al. 2007)
Der kürzlich veröffentlichte Bericht zur Inzidenz von soliden Tumoren bei den Atombombenüberlebenden schließt einen Beobachtungszeitraum von 1958 bis 1998 ein. In diesem Bericht werden relative und absolute zusätzliche Risiken diskutiert, und zwar sowohl für alle soliden Tumoren zusammen als auch für einzelne Organe separat, falls die Anzahl der strahleninduzierten Fälle ausreichend ist. Neben anderen Parametern wird dabei auch die Abhängigkeit der Risiken vom Geschlecht ausgewertet [Pre 07].
- 2.2.1
- Alle Tumoren zusammen
Tabelle A8 zeigt das Ergebnis dieser Auswertung jeweils für den Fall, dass alle soliden Tumorarten oder dass nur geschlechtsunabhängige Tumorarten ohne Krebs an Brust, Prostata und anderen Geschlechtsorganen erfasst werden.
Tab. A8: ERR- und EAR-Werte für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren; die angegebenen Unsicherheitsbereiche entsprechen 90%-Konfidenzintervallen; unter der Rubrik „geschlechtsunabhängige solide Tumoren“ sind alle Tumoren außer die bei Brust, Prostata und anderen Geschlechtsorganen zusammengefasst [Pre 07].
Alle Tumoren | Männer (M) | Frauen (F) | Mittelwert | F/M |
Alle soliden Tumoren | ||||
ERR / Gy | 0,35 (0,28; 0,43) | 0,58 (0,43; 0,69) | 0,47 (0,40; 0,54) | 1,6 (1,31; 2,09) |
EAR / 104 PY Gy | 43 (33; 55) | 60 (51; 69) | 52 (43; 60) | 1,4 (1,10; 1,79) |
Geschlechtsunabhängige solide Tumoren | ||||
ERR / Gy | 0,34 (0,27; 0,42) | 0,61 (0,50; 0,43) | 0,48 (0,39; 0,56) | 1,8 (1,31; 2,09) |
EAR / 104 PY Gy | 48 (36; 61) | 44 (37; 52) | 46 (38; 55) | 0,9 (0,72; 1,20) |
Wenn alle soliden Tumoren zusammengefasst werden, ergeben sich wie bei den Mortalitätsdaten (siehe Tabelle A6) höhere ERR-Werte für Frauen als für Männer. Im Gegensatz zu den Mortalitätsdaten sind hier jedoch auch die EAR-Werte für Frauen höher als für Männer, wenn auch in etwas geringerem Maße als die ERR-Werte. Preston und Mitarbeiter bemerken dazu: „While apparent gender effects on the ERR may reflect differences in background cancer rates and/or possible gender differences in radiosensitivity, gender differences in the EAR which is not influenced by background rates, might be thought to be a more direct indication of gender differences in radiosensitivity”. Werden geschlechtsspezifische Organe (weibliche Brust, Prostata, andere Geschlechtsorgane) in der Auswertung nicht mit berücksichtigt, bleibt der Unterschied in den ERR-Werten für Männer und Frauen weiter bestehen, vermutlich auf Grund der unterschiedlichen Spontanraten („These results suggest that the greater ERR for women than men largely reflects gender differences in the background rates“). Die EAR-Werte für Männer und Frauen sind jedoch nicht mehr signifikant verschieden (F/M = 0,9), ein Ergebnis, das mit dem aus den Mortalitätsdaten übereinstimmt.
- 2.2.2
- Magen
Magenkrebs stellt die häufigste Krebsart in Japan dar. Verglichen mit dem globalen Durchschnitt sind die spontanen Inzidenzraten in Japan für Magenkrebs etwa zehnmal höher. In der LSS beträgt der Anteil der Magenkrebsfälle (insgesamt 4 730 Fälle) an allen Krebsfällen 27%. Unter Anwendung einer linearen Dosis-Wirkungs-Beziehung ergeben die Analysen von Preston und Mitarbeitern 151 strahleninduzierte Magenkrebsfälle, wobei etwa ein Drittel der Fälle von Überlebenden mit Magendosen größer als 1 Gy kommen. Was die spontan auftretenden Magenkrebsraten angeht, zeigen sowohl die globalen Daten als auch die aus der LSS abgeleiteten Daten einen deutlich höheren Wert für Männer als für Frauen (siehe Tabelle A9).
Tabelle A9 zeigt das bereits weiter oben diskutierte Muster: der ERR-Wert für Frauen ist etwa einen Faktor 2 höher als der für Männer. Dies kann dadurch erklärt werden, dass bei der Spontaninzidenz der entsprechende Wert für Frauen etwa einen Faktor 2 kleiner ist als der für Männer. Entsprechend zeigen die EAR-Werte für Männer und Frauen keinen signifikanten Unterschied.
Tab. A9: ERR- und EAR-Werte (Magentumore) für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren; die angegebenen Unsicherheitsbereiche entsprechen 90%-Konfidenzintervallen [Pre 07].
Magen | Männer (M) | Frauen (F) | Mittelwert | F/M |
ERR / Gy | 0,21 (0,10; 0,34) | 0,47 (0,29; 0,68) | 0,34 (0,22; 0,47) | 2,3 (1,2; 4,5) |
EAR / 104 PY Gy | 9,4 (4,4; 16) | 9,7 (6,4; 14) | 9,5 (6,1; 14) | 1,0 (0,5; 2,1) |
Spontanrate (Japan) | - | - | - | 0,39 |
Spontanrate (LSS) | - | - | - | 0,29 – 0,40 |
- 2.2.3
- Kolon
Die Spontaninzidenz von Kolonkrebs ist in Japan in den letzten 25 Jahren stark angestiegen, und zwar stärker für Männer als für Frauen. Im globalen Mittel sind die altersstandardisierten Raten für Männer etwa doppelt so hoch wie die der Frauen. Kolonkrebs stellt in Japan die dritthäufigste Krebsart nach Magen- und Lungenkrebs dar. Die Spontaninzidenz-Raten, die sich aus der Analyse der LSS-Kohorte ergeben, spiegeln diese Trends (Anstieg mit der Zeit; doppelt so hohe Werte für Männer als für Frauen für das Geburtsjahr 1900) wider. Die Anwendung einer linearen Dosis-Wirkungs-Beziehung ergibt 78 strahleninduzierte Kolonkrebsfälle von insgesamt 1 516 Fällen.
Tab. A10: ERR- und EAR-Werte (Kolontumore) für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren; die angegebenen Unsicherheitsbereiche entsprechen 90%-Konfidenzintervallen [Pre 07].
Kolon | Männer (M) | Frauen (F) | Mittelwert | F/M |
ERR / Gy | 0,73 (0,38; 1,17) | 0,34 (0,13; 0,63) | 0,54 (0,30; 0,81) | 0,5 (0,17; 1,01) |
EAR / 104 PY Gy | 13,0 (4,4; 16) | 3,0 (6,4; 14) | 8,0 (4,4; 12) | 0,2 (0,06; 0,52) |
Spontanrate (Japan) | - | - | - | 0,59 |
Spontanrate (LSS) | - | - | - | 0,5 (Geburtsjahr 1900) |
Für Kolonkrebs ist der ERR-Wert für Frauen nur etwa halb so groß wie der für Männer (Tabelle A10). Der EAR-Wert für Frauen ist um einen Faktor 5 niedriger als der der Männer. Vermutlich hängt dies damit zusammen, dass auch die Spontaninzidenz für Frauen nur halb so groß ist wie die für Männer. Damit stellt Kolonkrebs die einzige Krebsart dar, bei der der ERR-Wert für Frauen deutlich geringer ist als der für Männer.
- 2.2.4
- Leber
Japan gehört zu den Ländern mit einer hohen Spontaninzidenz von Leberkrebs, hauptsächlich hervorgerufen durch Hepatitis-B- und -C-Viren. Für japanische Männer ist die altersstandardisierte Spontanrate etwa dreimal höher als für Frauen. Entsprechend finden sich auch in der LSS-Kohorte für Männer drei- bis viermal höhere Spontanraten. Die Anwendung einer linearen Dosis-Wirkungs-Beziehung ergibt 54 strahleninduzierte Fälle von insgesamt 1 494 Fällen.
Tab. A11: ERR- und EAR-Werte (Lebertumore) für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren; die angegebenen Unsicherheitsbereiche entsprechen 90%-Konfidenzintervallen [Pre 07].
Leber | Männer (M) | Frauen (F) | Mittelwert | F/M |
ERR / Gy | 0,32 (0,12; 0,60) | 0,28 (0,05; 0,63) | 0,30 (0,11; 0,55) | 0,9 (0,16; 2,4) |
EAR / 104 PY Gy | 6,4 (0,2; 12) | 2,1 (0,6; 4,3) | 4,3 (0,2; 7,2) | 0,3 (0,10; 0,32) |
Spontanrate (Japan) | - | - | - | 0,32 |
Spontanrate (LSS) | - | - | - | 0,25 – 0,33 |
Tabelle A11 zeigt, dass für Leberkrebs die ERR-Werte für Männer und Frauen ähnlich sind. Der deutlich geringere EAR-Wert für Frauen als für Männer spiegelt im Wesentlichen die entsprechenden Unterschiede in den Spontanraten wider.
- 2.2.5
- Lunge
Lungenkrebs ist die häufigste Krebserkrankung weltweit. In Japan ist sie die zweithäufigste bei Männern und die fünfthäufigste bei Frauen. Der dort beobachtete Anstieg der Inzidenzraten mit der Zeit ist hauptsächlich auf die sich ändernden Rauchgewohnheiten zurückzuführen. Die Anwendung einer linearen Dosis-Wirkungs-Beziehung ergibt 117 strahleninduzierte Fälle von insgesamt 1 759 Fällen.
Tab. A12: ERR- und EAR-Werte (Lungentumoren) für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren; die angegebenen Unsicherheitsbereiche entsprechen 90%-Konfidenzintervallen [Pre 07].
Lunge | Männer (M) | Frauen (F) | Mittelwert | F/M |
ERR / Gy | 0,28 (0,12; 0,49) | 1,33 (0,91; 1,8) | 0,81 (0,56; 1,1) | 4,8 (2,6; 12) |
EAR / 104 PY Gy | 6,0 (2,3; 11) | 9,1 (6,4; 12) | 7,5 (5,1; 10) | 1,5 (0,82; 3,9) |
Spontanrate (Japan) | - | - | - | 0,31 |
Spontanrate (LSS) | - | - | - | 0,26 – 0,27* |
* je nach Geburtsjahrgang
Tabelle A12 zeigt, dass für Lungenkrebs der ERR-Wert für Frauen deutlich höher als der für Männer ist, während die entsprechenden EAR-Werte ähnlich sind. Der deutlich geringere EAR-Wert für Frauen als für Männer spiegelt im Wesentlichen die entsprechenden Unterschiede in den Spontanraten wider. Die Lunge stellt das Organ dar, das bei den ERR-Werten das größte F/M-Verhältnis aufweist.
An dieser Stelle muss jedoch darauf hingewiesen werden, dass in der Studie von Preston und Mitarbeitern keine Anpassung an das Rauchverhalten der Überlebenden durchgeführt wurde. In einer etwas früher veröffentlichten Studie wurde jedoch eine derartige Anpassung für Überlebende, für die Informationen zum Rauchverhalten vorhanden waren, durchgeführt [Pie 03]. Die Autoren berichten von einem ursprünglichen F/M-Verhältnis von 5,8 für den ERR-Wert, der sich nach Anpassung an das Rauchverhalten auf einen Wert von 1,6 verringert.
- 2.2.6
- Blase
Blasenkrebs trägt in Japan weniger als 3% zu allen Krebsarten bei. Im Jahre 1999 war die altersstandardisierte Spontanrate in Japan für Männer 4,4mal höher als für Frauen. In der LSS wurden bei Anwendung einer linearen Dosis-Wirkungs-Beziehung der ionisierenden Strahlung 35 Blasenkrebsfälle von insgesamt 469 beobachteten Fällen zugeordnet. Mit einem mittleren ERR-Wert von 1,23/Gy ist die Blase das Organ mit dem höchsten ERR.
Tab. A13: ERR- und EAR-Werte (Blasentumoren) für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren; die angegebenen Unsicherheitsbereiche entsprechen 90%-Konfidenzintervallen [Pre 07].
Blase | Männer (M) | Frauen (F) | Mittelwert | F/M |
ERR / Gy | 0,61 (0,11; 1,2) | 1,9 (0,79; 3,4) | 1,23 (0,59; 2,1) | 3,1 (0,17; 10) |
EAR / 104 PY Gy | 3,8 (0,2; 8,0) | 2,6 (1,1; 4,4) | 3,2 (1,1; 5,4) | 0,7 (0,21; 10) |
Spontanrate (Japan) | - | - | - | 0,23 |
Tabelle A13 zeigt, dass für Blasenkrebs der ERR-Wert für Frauen etwa dreimal höher als der für Männer ist, wobei die damit verbundene Unsicherheit auf Grund der geringen Anzahl strahleninduzierter Fälle hoch ist. Dieses Verhältnis wird in der LSS nur noch von Lungenkrebs übertroffen, wo der entsprechende Wert 4,8 ist (Tabelle A12). Ein Großteil des Unterschieds des ERR zwischen Männern und Frauen lässt sich dadurch erklären, dass Männer ein viel größeres spontanes Risiko tragen, an Blasenkrebs zu erkranken. Entsprechend ist der Unterschied der EAR-Werte für Männer und Frauen deutlich geringer (F/M-Verhältnis: 0,7; Tabelle A13).
- 2.2.7
- Schilddrüse
Weltweit tritt Schilddrüsenkrebs deutlich häufiger bei Frauen als bei Männern auf. Dies ist auch an den entsprechenden Daten für 1999 für Japan erkennbar, die ein F/M-Verhältnis von 4,1 ergeben. Damit stellt die Schilddrüse eine Ausnahme dar – bei allen anderen untersuchten Organen sind die entsprechenden spontanen Krebshäufigkeiten bei Männern höher als bei Frauen. In der LSS-Kohorte wurden im Zeitraum zwischen 1958 und 1998 471 Schilddrüsenkrebsfälle beobachtet, davon 381 bei Frauen und 90 bei Männern. Bei Anwendung einer linearen Dosis-Wirkungs-Beziehung werden der ionisierenden Strahlung 63 Schilddrüsenkrebsfälle zugeordnet.
Tab. A14: ERR- und EAR-Werte (Schilddrüsentumoren) für ein Alter bei Exposition von 30 Jahren und ein erreichtes Alter von 70 Jahren; die angegebenen Unsicherheitsbereiche entsprechen 90%-Konfidenzintervallen [Pre 07].
Schilddrüse | Männer (M) | Frauen (F) | Mittelwert | F/M |
ERR / Gy | 0,49 (0,15; 1,15) | 0,65 (0,27; 1,25) | 0,57 (0,24; 1,1) | 1,3 (0,56; 3,9) |
EAR / 104 PY Gy | 0,5 (0,3; 1,5) | 1,9 (1,3; 4,2) | 1,2 (0,48; 2,2) | 3,6 (1,78; 9,5) |
Spontanrate (Japan) | - | - | - | 4,1 |
Tabelle A14 zeigt, dass für Schilddrüsenkrebs Frauen ein etwa 30% höheres ERR aufweisen als Männer. Auf Grund der deutlichen Unterschiede zwischen Männer und Frauen beim spontanen Auftreten von Schilddrüsenkrebs (siehe oben) weisen Frauen einen um den Faktor 3,6 höheren EAR-Wert auf als Männer. Dies ist das höchste beim zusätzlichen absoluten Risiko in der Studie beobachtete F/M-Verhältnis.
- 2.2.8
- Andere Organe
Für die übrigen untersuchten Organe (Mundhöhle und Speicheldrüse, Speiseröhre, Rektum, Gallenblase, Bauchspeicheldrüse, Gehirn) konnte auf Grund der geringen Anzahl aufgetretener strahleninduzierter Krebsfälle eine Abhängigkeit des relativen und absoluten Risikos vom Geschlecht nicht bestimmt werden.
- 2.3
- Gepoolte Studie zum Auftreten von strahleninduziertem Schilddrüsenkrebs (Ron et al. 1995)
In einer detaillierten Studie untersuchten Ron und Mitarbeiter das Auftreten von strahleninduziertem Schilddrüsenkrebs, indem sie die Ergebnisse von 7 Einzelstudien kombinierten. Diese Studien schließen fünf Kohortenstudien und 2 Fall-Kontrollstudien ein (siehe Tabelle A15, in der einige Eigenschaften dieser Studien aufgelistet sind).
Tab. A15: In der gepoolten Studie von [Ron 95] verwendete Kohorten; LSS: Life Span Study; MRH: Michael Reese Hospital; CHMC: Children’s Hospital Medical Center.
Kohortenstudien | ||||||
Studie | Anzahl, exponiert | Anzahl, nicht exponiert | Anteil Frauen (%) | Jahre Exposition | Dauer Follow- | Mittleres Alter bei Exposition |
LSS (Japan) | 41 234 | 38 738 | 60 | 1945 | 24 | 27 |
Thymus (USA) | 2 475 | 4 991 | 42 | 1926- | 35 | 0,1 |
Tinea Capitis (Israel) | 10 834 | 16 226 | 51 | 1948- | 30 | 7 |
Tonsillitis (MRH, USA) | 2 634 | 0 | 40 | 1939- | 33 | 4 |
Tonsillitis (CHMC, USA) | 1 192 | 1 063 | 40 | 1938- | 29 | 6 |
Fall- | ||||||
Studie | Fälle | Kontrollen | Anteil Frauen (%) | Jahre Exposition | Follow- | Mittleres Alter bei Exposition |
Zervix (international) | 43 | 81 | 100 | 1926- | - | 53 |
Kinderkrebs (international) | 22 | 82 | 45 | 1936- | - | 7 |
Tabelle A15 zeigt, dass die von Ron und Mitarbeitern für die Gesamtstudie ausgewählten Studien sehr heterogen sind. Dies trifft umso mehr zu, als auch die Expositionsbedingungen zwischen den Studien sich zum Teil deutlich unterscheiden (im Hinblick auf Dosisbereich, Feldgröße, Energie der verwendeten Strahlung, Fraktionierung usw.). Es überrascht daher nicht, dass die in diesen Studien abgeleiteten Risikoschätzungen zum Teil stark voneinander abweichen (Tabelle A16).
Tab. A16: Von Ron und Mitarbeitern aus den Daten verschiedener Studien abgeleitete ERR- und EAR-Werte für Schilddrüsenkrebs; KI: Konfidenzintervall, [Ron 95].
Alter bei Exposition < 15 Jahre | ERR/Gy (95%- | EAR pro Gy und |
Thymus | 9,1 (3,6; 28,8) | 2,6 (1,7; 3,6) |
LSS | 4,7 (1,7; 10,9) | 2,7 (1,2; 4,6) |
Tinea Capitis | 32,5 (14,0; 57,1) | 7,6 (2,7; 13,0) |
Tonsillitis (MRH) | 2,5 (0,6; 26,0) | 3,0 (0,5; 17,1) |
Kinderkrebs | 1,1 (0,4; 29,4) | - |
Alter bei Exposition | ERR/Gy (95%- | EAR pro Gy und |
Zervix | 34,9 (- | - |
LSS | 0,4 (- | 0,4 (- |
Dem entsprechend sind auch die aus diesen Studien abgeleiteten Unterschiede der Risikokoeffizienten für Männer und Frauen deutlich unterschiedlich (Tabelle A17). Ron und Mitarbeiter kommen zu dem Schluss, dass sich für Frauen ein um etwa den Faktor 2 höherer ERR-Wert ergibt als für Männer, wenn die Ergebnisse aller Studien zusammengefasst werden. Dieser Unterschied ist jedoch nicht signifikant („Results on gender differences in sensitivity for developing radiation-induced thyroid cancer have been inconsistent. Higher ERRs/Gy for women than men have been reported from some studies, but the opposite effect has also been noted. In the joint analysis, the ERR was higher for females than for males, but the difference was not statistically significant.”). Da die Spontanrate für das Auftreten von Schilddrüsenkrebs bei Frauen ebenfalls höher ist, ist auch der EAR-Wert für Frauen höher als für Männer. Dieser Befund ist mit dem aus [Pre 07] kompatibel (Kapitel 2.2.7).
Tab. A17: In [Ron 95] angegebene Werte für das M/F-Verhältnis (basierend auf den ERR-Werten in Tabelle A16).
Studie | M/F (ERR) |
Thymus |
|
LSS (< 15 Jahre) | 2,9 |
LSS (≥ 15 Jahre) | 0,2 |
Tinea Capitis | 0,2 |
Tonsilis (MRH) | 1,8 |
Kinderkrebs | 0,6 |
zusammen | 0,5 |
- 2.4
- Studie zum Auftreten von Schilddrüsenkarzinomen nach dem Unfall von Tschernobyl (Jacob et al. 2006, SSK 2006)
In einer detaillierten Studie untersuchten Jacob und Mitarbeiter das Auftreten von Schilddrüsenkarzinomen bei Kindern und Jugendlichen der Geburtsjahre zwischen 1968 und 1985 aus Gegenden in Weißrussland und der Ukraine. Als Grundlage dienten Daten aus insgesamt 1 034 Ortschaften, in denen nach dem Unfall von Tschernobyl im Mai und Juni 1986 mindestens 10 Messungen der I-131-Aktivität in der Schilddrüse durchgeführt worden waren (Ukraine: 608 Ortschaften mit 75 313 Messungen; Weißrussland: 426 Ortschaften mit 90 699 Messungen). Basierend auf den Aktivitätsmessungen wurden individuelle Schilddrüsendosen berechnet. Bei etwa 100 000 untersuchten Personen traten Schilddrüsendosen von mehr als 0,3 Gy auf. Innerhalb einzelner Ortschaft traten individuelle Unterschiede der Schilddrüsendosis von bis zu einem Faktor 50 auf. Aus den individuellen Dosiswerten wurden geschlechts- und alterspezifische Schilddrüsendosis in den einzelnen Ortschaften abgeschätzt. In mehr als 30 Ortschaften wurden Schilddrüsendosen von mehr als 3 Gy abgeschätzt. Zum Zeitpunkt des Unfalls wohnten in den untersuchten ukrainischen Orten 997 000, in den weißrussischen Orten 623 000 Kinder und Jugendliche.
Als Grundlage für die Bestimmung der aufgetretenen Schilddrüsenkrebsfälle wurden die im Zeitraum zwischen 1990 und 2001 in beiden Ländern an Kindern und Jugendlichen der Geburtsjahrgänge 1968-1985 durchgeführten Schilddrüsenoperationen herangezogen. Für die untersuchten ukrainischen Ortschaften wurden 512 Fälle berichtet (378 bei Mädchen, 134 bei Jungen). Analog fanden sich für die untersuchten weißrussischen Ortschaften 577 Fälle (368 bei Mädchen, 209 bei Jungen). Für das spontane Auftreten von Schilddrüsenkrebs ergab sich für beide Länder im Mittel ein Wert von 14 Fällen pro 106 Personenjahre für 20-Jährige in der Mitte der neunziger Jahre des letzten Jahrhunderts. Im untersuchten Altersbereich (5 bis 33 Jahre) wurde ein Anstieg der spontanen Schilddrüsenkrebsinzidenz mit dem Alter proportional zu (Alter)3,8 gefunden. Für Mädchen ergab sich eine um den Faktor 5,9 höhere spontane Rate als für Jungen. Ähnliches wurde zum Beispiel auch in der LSS beobachtet, wo für die spontanen Raten von einem F/M-Verhältnis von 4,1 berichtet wird (siehe Kapitel 2.2.7).
Für die lineare Steigung der Dosis-Wirkungs-Kurve ergab sich insgesamt ein ERR/Gy-Wert (Steigung der linearen Komponente der Dosis-Wirkungs-Kurve) von 18,9 (95%-KI: 11,1; 26,7). Für das F/M-Verhältnis geben die Autoren einen Wert von 1/3,8 = 0,26 an. Was die Altersabhängigkeit angeht, verringert sich das ERR bei einer Verdopplung des Alters um den Faktor 6,5. Ein F/M-Wert von 0,26 für das ERR steht im Widerspruch zum Ergebnis der gepoolten Studie von Ron und Mitarbeitern, die von einem (nicht-signifikanten) F/M-Wert von 2 berichten (Kapitel 2.3), und zum Ergebnis der LSS, in der ein F/M-Wert von 1,3 (0,56; 3,9) abgeleitet wird (Kapitel 2.2.7, Tabelle A14). Wenn jedoch die ERR-Daten des Auftretens von Schilddrüsentumoren in der LSS getrennt für Überlebende, die bei der Explosion jünger als 15 Jahre alt waren, herangezogen werden, ergibt sich ein F/M-Wert von 0,34 (siehe Tabelle A17), was mit den Ergebnissen von Jacob und Mitarbeiter kompatibel ist.
Für das zusätzliche absolute Risiko ergibt sich ein bester Schätzwert (Steigung der linearen Komponente der Dosis-Wirkungs-Kurve) von 2,66 Fälle pro 104 Personenjahre (95%-KI: 2,19; 3,13). Hier ergibt sich ein F/M-Wert von 1,5. Das EAR ist also für Frauen größer als für Männer, obwohl das ERR für Frauen deutlich geringer ist. Dieser Unterschied erklärt sich wieder aus der deutlich unterschiedlichen Spontanrate (F/M = 5,9; siehe oben). Die Tatsache, dass die Spontanrate schneller mit dem erreichten Alter steigt als das zusätzliche relative Risiko bedeutet, dass das zusätzliche absolute Risiko mit dem erreichten Alter ansteigt. Das um den Faktor 1,5 höhere EAR für Frauen als für Männer vergleicht sich mit einem F/M-Wert für das EAR von 3,6 (1,78; 9,5), wie er für die LSS für die Atombombenüberlebenden (alle Alter bei Exposition) angegeben wird (siehe Kapitel 2.2.7, Tabelle A14).
- 2.5
- Studien an Kindern und Jugendlichen aus Bryansk zum Auftreten von Schilddrüsenkarzinomen nach dem Unfall von Tschernobyl
(Ivanov et al. 2006)
In einer Studie zum Auftreten von Schilddrüsenkrebs untersuchten Ivanov und Mitarbeiter [Iva 06] Kinder und Jugendliche (Alter bei Exposition 0–17 Jahre) aus Bryansk, der am stärksten vom Fallout nach Tschernobyl betroffenen Gegend Russlands. Die Studie umfasste einen Untersuchungszeitraum von 1991 bis 2001 und beinhaltete insgesamt 373 827 Personen. Zur Dosisbestimmung wurden in Russland entwickelte Standardverfahren verwendet, bei denen der Wohnort und das Alter bei Exposition die wesentlichen Dosis-bestimmenden Parameter darstellen. Insgesamt wurden im Untersuchungszeitraum 199 Fälle (144 bei Jungen und 55 bei Mädchen) identifiziert. Die mittlere Schilddrüsendosis betrug für die untersuchte Population 0,08 Gy, für die männlichen Fälle 0,22 Gy und für die weiblichen 0,09 Gy.
Die Studie zeigte, dass das Auftreten von Schilddrüsenkrebs in der untersuchten Kohorte verglichen mit der für Russland abgeleiteten Spontanrate deutlich erhöht war: es ergab sich für Mädchen ein SIR-Wert (Standardised Incidence Ratio) von 4,9 (95%-KI: 4,2; 5,8) und für Jungen von 8,8 (95%-KI: 6,6; 11,5). Gründe für die erhöhten SIR-Werte könnten laut den Autoren der Studie in lokalen Unterschieden der Spontanraten und Melderaten liegen sowie in den unterschiedlichen Strahlenexpositionen.
Unter Verwendung einer internen Kontrollgruppe ergab sich für Mädchen für ein Alter bei Exposition von 0-4 Jahre ein ERR/Gy-Wert von 45,3 (95%-KI: 5,2; 9 953) und für Mädchen für ein Alter bei Exposition von 5-9 Jahre ein ERR/Gy-Wert von 10,1 (95%-KI: -0,1; 84,7). Für Jungen für ein Alter bei Exposition von 0-9 Jahre dagegen fand sich ein höherer ERR/Gy-Wert von 68,8 (95%-KI: 10,0; 4 520).
Die Autoren betonen abschließend, dass die erzielten Ergebnisse sehr große Konfidenzintervalle aufweisen. Da zudem die Dosisabschätzungen große Unsicherheiten beinhalten und auch der Einfluss von Screening-Effekten nicht auszuschließen ist, empfehlen sie, die Ergebnisse als vorläufig anzusehen. In einer zwei Jahre früher in Bryansk durchgeführten Studie wurde zwar von leicht erhöhten Risiken für Mädchen im Gegensatz zu Jungen berichtet, jedoch ebenfalls kein statistisch signifikanter Unterschied nachgewiesen [Dav 04].
Endgültige Schlussfolgerungen im Hinblick auf Unterschiede des Auftretens von Schilddrüsentumoren bei Mann und Frau lassen sich daher aus diesen Studien nicht ziehen.
- 2.6
- Lungenkrebs nach Behandlung von Morbus Hodgkin und Vergleich mit den Ergebnissen anderer Studien (Gilbert et al. 2003)
Gilbert und Mitarbeiter beschreiben das Ergebnis einer internationalen Studie zum Auftreten von Lungenkrebs nach Behandlung von Morbus Hodgkin [Gil 03]. Besonderheiten der Studie sind die große Anzahl an untersuchten Personen (227 Hodgkin-Patienten mit Lungenkrebs und 455 angepasste Kontrollpatienten), eine Dosisangabe für die Stelle, an der der Lungentumor aufgetreten war, und das Vorhandensein detaillierter Informationen zur Chemotherapie und zum Tabakgenuss. Zum letzteren wurden die folgenden Kategorien eingeführt: „never smoker“, „current cigarette smoker“, „former cigarette smoker“, „cigar and pipe smoker only“, „no information“. Die Menge der gerauchten Zigaretten wurde in Packungen pro Tag angegeben. Außerdem wurden in der Auswertung die Anzahl der applizierten Chemotherapie-Zyklen berücksichtigt. Es wurde angenommen, dass die Chemotherapie und die ionisierende Strahlung additiv, das Rauchen dazu jedoch multiplikativ wirkt.
In Bezug auf ionisierende Strahlung fanden Gilbert und Mitarbeiter für Männer ein etwa viermal höheres ERR als für Frauen (Tabelle A18), der Unterschied war jedoch nicht statistisch signifikant („The ERR/Gy for males was about four times that for females, although the difference was not statistically significant.“). Gilbert und Mitarbeiter verglichen dieses Ergebnis mit dem anderer Studien (siehe Tabelle A18) und weisen auf die zum Teil deutlich variierenden ERR-Werte hin. Sie führen dies unter anderem auf unterschiedliche Spontanraten (z.B. auf die niedrigen Spontanraten in Japan), unterschiedliche Dosiswerte, Fraktionierung, Dosisraten und einen möglicherweise nicht ausreichend berücksichtigten Einfluss von Rauchen und Chemotherapie zurück. Die Ergebnisse von [Gil 03] stehen damit im Widerspruch zu denen, die aus der LSS abgeleitet werden können (Kapitel 2.2.5), selbst dann, wenn dort auf das Rauchen korrigiert wurde.
Tab. A18: ERR-Werte (ERR/Gy) für Lungenkrebs, getrennt für Männer und Frauen (unter Berücksichtigung von Chemotherapiezyklen und Rauchen) und Vergleich mit den Ergebnissen anderer Studien [Gil 03].
Männer (M) | Frauen (F) | Mittelwert | F/M | Ref. |
0,18 (0,063; 0,52) | 0,044 (- | 0,15 (0,057; 0,39) | 0,24 | Hodgkin [Gil 03] |
0,34 (0,06; 0,69) | 0,89 (0,41; 1,51) | 0,53 (0,28; 0,84) | 2,6 | LSS Mortalität [Pie 96] |
0,47 (0,14; 0,90) | 1,97 (1,21; 2,95) | 0,95 (0,60; 1,36) | 4,2 | LSS Inzidenz [Tho 94] |
0,02 (- | - | 0,00 (- | - | [How 95] |
- 2.7
- Lungenkrebs bei Mayak-Arbeitern (Gilbert et al. 2004)
Die Kohorte der Mayak-Arbeiter erlaubt Untersuchungen der Folgen nach Inkorporation von Plutonium und nach Exposition durch externe protrahierte Dosen. In der von Gilbert und Mitarbeitern veröffentlichten Studie [Gil 04] wurden insgesamt 21 790 Arbeiter (davon 16 458 Männer) untersucht, die zwischen 1948 und 1972 in eine der dortigen Produktionsanlagen (Kernreaktoren, radiochemische Fabriken, Plutoniumherstellung) eingestellt worden waren. In einem Untersuchungszeitraum von 1955 bis Ende 2000 wurden in dieser Kohorte 8 493 Todesfälle registriert, wobei für 97% die Todesursache bestimmt werden konnte. Dabei ergaben sich 594 Todesfälle durch Lungenkrebs bei Männern und 61 bei Frauen.
Tab. A19: ERR- und EAR-Werte (Lungentumoren) für ein erreichtes Alter von 60 Jahren; die angegebenen Unsicherheitsbereiche entsprechen 95%-Konfidenzintervallen [Gil 04].
Lungenkrebs | Männer (M) | Frauen (F) | F/M |
Interne Exposition | |||
ERR / Gy | 4,4 (3,6; 6,7) | 19 (9,5; 39) | 4,0 (1,9; 8,8) |
EAR / 104 PY Gy | 115 (81; 156) | 49 (29; 78) | 0,43 (0,24; 0,72) |
Externe Exposition | |||
ERR / Gy | 0,17 (0,052; 0,32) | 0,32 (<0; 1,3) | 1,9 (<0; 11) |
EAR / 104 PY Gy | 2,4 (0,56; 4,4) | 0,43 (<0; 1,6) | 0,18 (<0; 1,1) |
Die Bestimmung der externen Exposition der Mitglieder der Kohorte erfolgte auf der Basis von Filmdosimeter-Messungen, die seit 1948 routinemäßig durchgeführt worden waren. Für 80% der Personen waren derartige Daten verfügbar. Die mittlere externe Dosis der überwachten Personen in der Kohorte lag bei 0,8 Gy. Eine systematische Überwachung der internen Dosen durch Inkorporation von Plutonium erfolgte seit Ende der 1960er Jahre. Dafür wurden Ausscheidungsmessungen (Urin) durchgeführt und auf der Basis aktuellster Modelle der Biokinetik von Plutonium im Menschen Dosiswerte für die Lunge errechnet. Für etwa 40% der in den radiochemischen Anlagen und bei der Plutoniumherstellung eingesetzten 14 715 Personen konnten auf diese Weise Lungendosen berechnet werden. Es ergaben sich mittlere Lungendosen von 0,21 Gy für die männlichen und 0,38 Gy für die weiblichen Angestellten. Für die Personen, für die keine experimentellen Daten verfügbar waren, wurde die Lungendosis u. a. basierend auf den Einsatzorten und den durchgeführten Arbeiten geschätzt.
Tabelle A19 zeigt die erhaltenen ERR- bzw. EAR-Werte für die Personen, die auf eine Inkorporation von Plutonium überwacht worden waren bzw. die nicht in den radiochemischen Anlagen oder in der Plutoniumherstellung gearbeitet hatten (nur externe Exposition).
Laut Gilbert und Mitarbeiter ergibt sich ein signifikant um den Faktor 4 höherer ERR/Gy-Wert für Frauen als für Männer bei interner Exposition. Der entsprechende Faktor von 1,9, der sich für externe Exposition ergibt, ist jedoch nicht signifikant. Für das absolute Risiko sind die Werte für Frauen jedoch geringer als für Männer, und es ergibt sich ein signifikanter Faktor von 0,43 bei interner Exposition sowie ein nicht-signifikanter Faktor von 0,18 für externe Exposition. Es sei darauf hingewiesen, dass sich die in Tabelle A19 ergebenden unterschiedlichen Werte für interne und externe Exposition durch eine relative biologische Wirksamkeit der internen Exposition (Alpha-Strahlung) von 33 (KI: 14; 98), verglichen mit der externen Exposition (Gamma-Strahlung), erklären lassen. Übrigens ergeben sich ähnliche ERR/Gy-Werte bei interner Exposition, wenn nur die Arbeiter berücksichtigt werden, die auf eine Plutonium-Inkorporation überwacht worden waren (Männer: 4,2 (KI: 2,8; 6,0); Frauen: 22 (KI: 9,5; 56); vgl. Tabelle A19). Auch wenn das Rauchverhalten berücksichtigt wurde (mit den Kategorien „ever smoker“ und „never smoker“ wurden 74% der Männer, aber nur 3,4% der Frauen als Raucher identifiziert), ergaben sich für die ERR/Gy-Werte keine signifikanten Unterschiede zu Tabelle A19 (Männer: 3,9 (KI: 2,6; 5,8); Frauen: 19 (KI: 7,7; 51); vgl. Tabelle A19). Was das Verhältnis Männer/Frauen im Hinblick auf die Spontanrate für Lungenkrebs angeht, ergab sich bei Berücksichtigung des Rauchverhaltens jedoch eine Änderung des Verhältniswerts von 11 auf 2.
Gilbert und Mitarbeiter vergleichen ihr Ergebnis mit dem, das sie aus der LSS bei entsprechender Altersstruktur (Alter bei Exposition: 16-60 Jahre; erreichtes Alter: 60 Jahre) erwarten würden und kommen für das ERR-Modell für das F/M-Verhältnis auf einen ähnlichen Wert von 3,6 (95%-KI: 1,2; 11) (vgl. Tabelle A19: 4,0 (95%-KI: 1,9; 8,8); Tabelle A18: 2,6 bzw. 4.2; Tabelle A12: 4,8 (90%-KI: 2,6; 12)).
Zusammenfassend wurde von [Gil 04] für Frauen ein etwa 4-fach höherer ERR/Gy-Wert als für Männer gefunden, dagegen ein etwa halb so großer EAR/Gy-Wert. Gilbert und Mitarbeiter führen dies auf die für Frauen und Männer deutlich unterschiedlichen Spontanraten zurück, was sich im Wesentlichen durch unterschiedliches Rauchverhalten erklären lässt („The different patterns for ERR and EAR models reflect the very strong difference in baseline risks for the two sexes with baseline risks for males estimated to be about 11 times those for females; smoking differences explain much of this difference.“).
- 2.8
- Organspezifische Inzidenz und Mortalität nach zerebraler Angiographie mit radioaktivem Thorotrast (Travis et al. 2003)
Travis und Mitarbeiter untersuchten das Krebsrisiko nach einer Langzeit-Exposition auf Grund inkorporierter Radionuklide, die beim Zerfall Alphateilchen aussenden [Tra 03]. Dazu verwendeten sie eine Kohorte aus insgesamt 3 042 Patienten, bei denen während einer zerebralen Angiographie entweder Thorotrast (Thorium-232) oder eine nichtradioaktive Substanz injiziert wurde. Die Kohorte setzte sich zusammen aus 1 953 Patienten aus Dänemark, 431 aus Schweden und 658 aus den USA. Obwohl der Schwerpunkt dieser Arbeit auf einer detaillierten Analyse der Risiken als Funktion der Inzidenz oder Mortalität einer bestimmten Krebsart lag, untersuchten die Autoren für alle Tumoren zusammen auch geschlechtsspezifische Unterschiede.
Die Autoren fanden in den dänisch/schwedischen Daten für die Inzidenz von allen Tumorarten ein relatives Risiko (RR) von 3,6 (95%-KI: 2,8; 4,8) für Männer und von 3,3 (95%-KI: 2,6; 4,2) für Frauen und kamen zu dem Schluss, dass sie keine geschlechtsspezifischen Unterschiede nachweisen konnten („… risks were similar for males and females.“). Sie erwähnten jedoch, dass sie bei Männern eine nicht-signifikante Erhöhung von Non-Hodgkin-Lymphomen (RR=2,5) und von Krebs des Rektums (RR=3,2), bei Frauen dagegen eine Erhöhung von Basalzell- und Plattenepithelkarzinomen (nonmelanoma skin cancer) (RR=2,8), multiplen Myelomen (RR=3,7), Kolonkrebs (RR=1,9), Lungenkrebs (RR=1,6) und Schilddrüsenkrebs (RR=1,8) beobachten konnten. Keiner dieser geschlechtsspezifischen Unterschiede ist jedoch statistisch signifikant („… none of the differences between men and women were statistically significant.“).
Es zeigt sich allerdings ein deutlicher Unterschied, wenn in den dänisch/schwedischen Daten getrennt weibliche (Gebärmutterhals, Gebärmutter, Eierstöcke) und männliche Geschlechtsorgane (Prostata, Hoden) ausgewertet wurden. Dann ergab sich für das RR für Frauen ein Wert von 1,1 (95%-KI: 0,6; 2,1), während sich für das RR für Männer ein Wert von 4,7 (95%-KI: 1,8; 15,0) ergab.
In den amerikanischen Daten berichten die Autoren für die Mortalität für alle Krebsarten von einem relativen Risiko (RR) von 3,9 (95%-KI: 2,0; 8,2) für Männer und von 4,1 (95%-KI: 2,1; 8,7) für Frauen.
- 2.9
- Studie zur Mortalität durch Leukämie unter den Atombombenüberlebenden (Preston et al. 2004)
Die neueste Arbeit, in der Daten zur Mortalität durch Leukämie unter den Atombombenüberlebenden zu finden sind, wurde von Preston und Mitarbeitern veröffentlicht [Pre 04]. Diese Autoren berichteten für den Follow-up-Zeitraum von 1950–2000 unter 86 955 Überlebenden von 296 Todesfällen durch Leukämie. Darunter sind 6 Fälle auf die chronische lymphatische Leukämie zurückzuführen. Die Autoren betonen, dass die Ergebnisse ihrer Analyse nur unwesentlich davon abhängen, ob diese sechs Fälle mit berücksichtigt werden oder nicht. Unter Verwendung eines linear-quadratischen Dosis-Modells schätzen Preston und Mitarbeiter ab, dass 93 der beobachteten 296 Fälle der ionisierenden Strahlung zugeordnet werden müssen. Basierend auf dem zusätzlichen absoluten Risiko EAR ergibt sich, dass Frauen ein signifikant niedrigeres Risiko als Männer aufweisen, und das entsprechende F/M-Verhältnis wird mit 0,6 (90%-KI: 0,4; 0,8) angegeben.
In [UNSC 08, Annex A, Tabelle 44] wird demonstriert, dass sich unter Verwendung der in [Pre 94] beschriebenen früheren Daten des absoluten Leukämie-Risikos (Inzidenz) für die Atombombenüberlebenden ein ähnliches F/M-Verhältnis ergibt. Allerdings zeigen diese Daten auch, dass für das zusätzliche relative Risiko kein größerer Unterschied zwischen Frauen und Männern besteht.
- 2.10
- Studie zu Leukämien an Arbeitern von vier US Kernwaffen-Produktionsstätten und einer Werft für Schiffe mit Nuklearantrieb (Schubauer-Berigan et al. 2007)
Für diese Studie wurden insgesamt 94 517 Personen, die in Hanford (36 384 Personen), am Oak Ridge National Laboratory (ORNL: 19 815 Personen), in Savannah River Site (SRS: 12 886 Personen), am Los Alamos National Laboratory (LANL: 12 179 Personen; Firma ZIA: 5 686 Personen) und in der Portsmouth-Schiffswerft (9 662 Personen) beschäftigt waren, untersucht (Sch 07). Alle Arbeiter waren wenigstens 30 Tage in den jeweiligen Einrichtungen beschäftigt und die ganze Zeit strahlenüberwacht. In diesen Kohorten wurden bei Follow-up-Zeiträumen zwischen 25 und 34 Jahren insgesamt 257 Todesfälle durch Leukämie (davon 206 nicht-CLL Fälle) beobachtet. Zusätzlich wurden 823 altersangepasste Kontrollfälle ausgewählt.
Die in der Studie für das Knochenmark angegebenen Dosen schließen Beiträge durch externe Quellen (Gamma- und Röntgenstrahlung) und interne Quellen (Tritium, Plutonium und Neutronen) ein. Wenn möglich wurden die Dosen unter Berücksichtigung spezieller Aspekte der verwendeten Dosimeter (Ansprechvermögen, Kalibrierung) korrigiert. Die mittlere kumulative Dosis für das Knochenmark lag bei den Fällen bei etwa 30 mSv. Außerdem wurden potentielle Expositionen mit Benzol und Tetrachlorkohlenstoff in die Klassen ‚hoch’, ‚mittel’, ‚niedrig’, ‚sehr niedrig’ und ‚nicht exponiert’ eingeteilt. Schließlich wurde der Zigarettenkonsum klassifiziert („never-smokers“, „ex-smokers“, „current smokers“). Beim Fehlen entsprechender Informationen wurde der sozioökonomische Status der Personen als Surrogat für das Rauchverhalten verwendet.
Werden Fälle mit unklarem Leukämietypus weggelassen und zum Beispiel die Exposition mit Lösungsmitteln berücksichtigt, ergibt sich ein (nicht-signifikanter) ERR-Wert von 2,6 (95%-KI: -1,0; 10,3) Sv-1. Die Autoren finden deutlich weniger Leukämie-Fälle bei Frauen als bei Männern („Women had less than half the age-adjusted non-CLL leukemia risk of men“), von den 206 nicht-CLL Fällen sind nur 15 bei Frauen aufgetreten. Detaillierte Analysen, in denen die Rolle potentieller Confounder (Rauchstatus, Exposition mit Benzol und Tetrachlorkohlenstoff, sozioökonomischer Status, Einstellungsjahr etc.) untersucht wurde, zeigen keinen wesentlichen Einfluss dieser Parameter auf die in der Studie erzielten Ergebnisse. Schubauer-Berigan et al. geben für das F/M-Verhältnis einen Wert von 0,42 (95%-KI: 0,23; 0,71) an, was zwar mit dem in Kapitel 2.9 beschriebenen und an den Atombombenüberlebenden gewonnenen EAR-Ergebnis übereinstimmt. Allerdings zeigen die in Kapitel 2.9 auch erwähnten Analysen von [UNSC 08] für das ERR k e i n e n geschlechtsspezifischen Unterschied für Leukämie.
- 2.11
- Weitere Studien zur strahleninduzierten Leukämie
In der Literatur finden sich eine Reihe weiterer epidemiologischer Studien, die sich mit der möglichen Induktion von Leukämie nach Exposition mit ionisierender Strahlung beschäftigen. Einige dieser Studien sind hier aufgeführt, obwohl in ihnen keine statistisch signifikanten Aussagen zu geschlechtsspezifischen Unterschieden getroffen werden konnten.
Beispielsweise wurde in der Studie von Krestinina und Mitarbeitern an den Bewohnern des Flusses Techa für Leukämie ohne CLL ein signifikanter Wert für das zusätzliche relative Risiko pro Dosis von 6,5 (95%-KI: 1,8; 24) Gy-1 gefunden [Kre 05]. Es ergab sich zudem im Widerspruch zu den in den Kapiteln 2.9 und 2.10 beschriebenen Ergebnissen ein höheres Risiko für die Frau als für den Mann. Allerdings ist dieser Unterschied statistisch nicht signifikant („While the ERR for women is estimated to be about 70% greater than that for men, the difference is not statistically significant.“).
Shilnikova und Mitarbeiter berichteten ebenfalls von einer signifikanten Erhöhung des Leukämierisikos ohne CLL [Shi 03]. Diese Autoren untersuchten 21 557 Mayak-Arbeiter (16 291 Männer und 5 266 Frauen) und fanden insgesamt 77 Todesfälle aufgrund von Leukämie. Ohne 11 CLL-Fälle traten 55 Leukämie-Todesfälle bei Männern und 11 bei Frauen auf. Unter der Annahme einer Latenzzeit von 2 Jahren und eines linearen Dosismodells ergab sich ein signifikanter ERR-Wert pro Dosis von 0,99 (90%-KI: 0,45; 2,12). Die genauere Analyse der Daten ergab ein für Frauen höheres Leukämierisiko (im Widerspruch zu dem in den Kapiteln 2.9 und 2.10 beschriebenen F/M-Verhältnis). Dieses Ergebnis ist jedoch statistisch nicht signifikant, und die Autoren schließen daraus, dass sie keine geschlechtsspezifischen Unterschiede nachweisen konnten („There was no evidence of a significant sex difference in the ERR (p > 0,5, female:male ratio 1,7 (90%-KI: 0,23; 11,2)) …“). Damit ergab sich ein ähnliches Ergebnis wie das, das von Krestinina und Mitarbeitern in ihrer Studie an der Bevölkerung des Flusses Techa erzielt wurde.
Auch die Studie von Muirhead und Mitarbeitern an 174 541 Arbeitern, die im britischen National Registry for Radiation Workers registriert sind, ergab eine signifikante Erhöhung des Leukämierisikos ohne CLL [Mui 09]. Diese Autoren berichten von Werten für das zusätzliche relative Risiko pro Dosis von 1,712 (90%-KI: 0,06; 4,29) Sv-1 (Mortalität) bzw. von 1,782 (90%-KI: 0,17; 4,36) Sv-1 (Inzidenz). Eine geschlechtsspezifische Auswertung der Daten im Hinblick auf ERR/ Sv-Werte wird jedoch nicht beschrieben.
In der internationalen 15-Länder Studie zum Krebsrisiko bei Beschäftigten in der Nuklearindustrie wurde bei 407 391 Personen im Untersuchungszeitraum 24 158 Todesfälle beobachtet, davon 196 Leukämiefälle. Es wurde ein signifikantes zusätzliches relatives Risiko pro Dosis für Leukämie errechnet (ERR/Sv = 1,93 (95%-KI: < 0; 8,47)). Dieses Ergebnis bezieht sich auf Grund der geringen Anzahl von Frauen in der untersuchten Kohorte jedoch hauptsächlich auf Männer [Car 05].
Boice und Mitarbeiter untersuchten die Leukämie-Mortalität von 5 801 Beschäftigten von in der Kerntechnik engagierten Firmen in den USA [Boi 06] und fanden keine signifikante Erhöhung in den exponierten Personengruppen. Dementsprechend liefert diese Studie auch keine Aussage über mögliche geschlechtsspezifische Unterschiede.
Untersuchungen an den Beschäftigten der Portsmouth-Schiffswerft ergaben eine nicht-signifikante Erhöhung der Leukämie-Mortalität (ERR/10 mSv=10,88% (95%-KI: -0,90%; 38,77%)) [Yii 05] beziehungsweise eine signifikante Erhöhung (OR=1,08 bei 10 mSv; 95%-KI: 1,01; 1,16)) [Kub 05]. Allerdings sind in dieser Kohorte mehr als 97% der Studienteilnehmer männlich, so dass eine geschlechtsspezifische Aussage zum Leukämierisiko nicht möglich war.
Die Studie von Mohan und Mitarbeitern basiert auf einer Kohorte von 146 022 Personen, die nachweislich zwei oder mehr Jahre im Zeitraum von 1926-1982 in den USA als Röntgenassistenten tätig waren [Moh 03]. Für Leukämie (ohne CLL) wurde eine nicht-signifikante Erhöhung der Mortalität bei denjenigen, die vor 1940 im Vergleich zu denjenigen, die später eingestellt wurden, festgestellt (RR = 1,64; 95%-KI: 0,42; 6,31). Zudem wurde ein signifikanter Anstieg der Mortalität mit zunehmender Beschäftigungsdauer vor 1950 festgestellt (basierend auf 15 in diesem Zeitraum beobachteten Leukämie-Todesfällen). Eine geschlechtsspezifische Auswertung des relativen Risikos wird in dieser Studie nicht beschrieben.
In der Studie von Möhner et al. zum Auftreten von Leukämie bei deutschen Uranbergarbeitern [Möh 06] wurden nur Männer untersucht, so dass eine geschlechtsspezifische Auswertung nicht möglich war.
Eine Studie von Wing et al. an den Hanford-Beschäftigten (19 684 Männer und 6 705 Frauen) ergab eine nicht-signifikante negative Korrelation des Leukämierisikos mit der Exposition, Aussagen zu geschlechtsspezifischen Unterschieden waren nicht möglich [Win 05].
Travis und Mitarbeiter fanden ein signifikant erhöhtes Leukämierisiko bei Patienten, bei denen während einer zerebralen Angiographie Thorotrast (Thorium-232) injiziert wurde (relatives Risiko, Inzidenz: 15,2 (95%-KI: 4,4; 149,6) in der dänisch/schwedischen Kohorte bzw. relatives Risiko, Mortalität: 16,8 (95%-KI: 0,6; 211,7) in der US-amerikanischen Kohorte) (siehe auch Kapitel 2.8), konnten jedoch keine geschlechtsspezifischen Angaben machen [Tra 03].
Die portugisische Thorotrast-Studie von dos Santos Silva umfasste 2.360 Personen. Es ergab sich zwar ein signifikant erhöhtes relatives Risiko für die Leukämie-Mortalität ohne CLL von 10,2 (95%-KI: 1,24; 471), geschlechtsspezifische Unterschiede wurden jedoch nicht berichtet [San 2003].
Wang und Mitarbeiter untersuchten bei in der Röntgendiagnostik beschäftigten Personen (Zeitraum 1950-1995) die Inzidenz von Krebs und berichteten von signifikant erhöhten Leukämierisiken. Eine explizite Auswertung möglicher geschlechtsspezifischer Unterschiede wird jedoch nicht präsentiert [Wan 02].
Literatur
[Boi 06] | Boice, J. D.; Cohen, S. S.; Mumma, M. T.; Ellis, E. D.; Eckerman, K. F.; Leggett, R. W.; Boecker, B. B.; Brill, A. B.; Henderson, B. E.: Mortality among radiation workers at Rocketdyne (Atomics International), 1948- |
[Car 05] | Cardis, E.; Vrijheid, M.; Blettner, M.; Gilbert, E.; Hakama, M.; Hill, C. et al.: Risk of cancer after low doses of ionising radiation: retrospective cohort study in 15 countries. BMJ 331(7508):77, 9 Jul 2005 |
[Dav 04] | Davis, S.; Stepanenko, V.; Rivkind, N.; Kopecky, K.; Voilleque, P.; Shakhtarin, V.; Parshkov, E.; Kulikov, S.; Lushnikov, E.; Abrosimov, A.; Troshin, V.; Romanova, G.; Doroschenko, V.; Proshin, A.; Tsyb, A.: Risk of thyroid cancer in the Bryansk oblast of the Russian Federation after the Chernobyl Power Station Accident. Radiat Res 162: 241- |
[Gil 03] | Gilbert, E. S.; Stovall, M.; Gospodarowicz, M.; van Leeuwen, F. E.; Andersson, M.; Glimelius, B.; Joensuu, T.; Lynch, C. F.: Curtis, R. E.; Holowaty, E.; Storm, H.; Pukkala, E.; van’t Veer, M. B.; Fraumeni, J. F. Jr; Boice, J. D. Jr; Clarke, E. A.; Travis, L. B.: Lung Cancer after Treatment for Hodgkin’s Disease: Focus on Radiation Effects. Radiat Res 159:161- |
[Gil 04] | Gilbert, E. S.; Koshurnikova, N. A.; Sokolnikov, M. E.; Shilnikova, N. S.; Preston, D. L.; Ron, E.; Okatenko, P. V.; Khokhryakov, V. F.; Vasilenko, E. K.; Miller, S.; Eckerman, K.; Romanov, S. A.: Lung Cancer in Mayak Workers. Radiat Res 162:505- |
[How 95] | Howe, G. R.: Lung cancer mortality between 1950 and 1987 after exposure to fractionated moderate- |
[ICRP 07] | International Commission on Radiological Protection (ICRP): The 2007 Recommendations of the International Commission on Radiological Protection. ICRP Publication 103. Ann. ICRP 37(2- |
[Iva 06] | Ivanov, V. K.; Gorski, A. K.; Tsyb, A. F.; Maksioutov, M. A.; Tumanov, K. A.; Vlasov, O. K.: Radiation- |
[Jac 06] | Jacob, P.; Bogdanova, T. I.; Buglova, E.; Chepurniy, M.; Demidchik, Y.; Gavrilin, Y.; Kenigsberg, J.; Meckbach, R.; Schotola, C.; Shinkarev, S.: Tronko, M. D.; Ulanovsky, A.; Vavilov, S.; Walsh, L.: Thyroid cancer risk in areas of Ukraine and Belarus affected by the Chernobyl accident. Radiat Res 165:1- |
[Kre 05] | Krestinina, L. Yu.; Preston, D. L.; Ostroumova, E. V.; Degteva, M. O.; Ron, E.; Vyushkova, O. V.; Startsev, N. V.; Kossenko, M. M.; Akleyev, A. V.: Protracted radiation exposure and cancer mortality in the Techa River Cohort. Radiat Res 164:602- |
[Kub 05] | Kubale, T. L.; Daniels, R. D.; Yiin, J. H.; Couch, J.; Schubauer- |
[Moh 03] | Mohan, A. K.; Hauptmann, M.; Freedman, D. M.; Ron, E.; Matanoski, G. M.; Lubin, J. H.; Alexander, B. H.; Boice, J. D. Jr; Doody, M. M.; Linet, M. S.: Cancer and other causes of mortality among radiologic technologists in the United States. Int J Cancer 103:259- |
[Möh 06] | Möhner, M.; Lindtner, M.; Otten, H.; Gille, H.- |
[Mui 09] | Muirhead, C. R.; O’Hagan, J. A.; Haylock, R. G. E.; Phillipson, M. A.; Willcock, T.; Berridge, G. L. C.; Zhang, W.: Mortality and cancer incidence following occupational radiation exposure: third analysis of the National Registry for Radiation Workers. British Journal of Cancer 100:206- |
[NIH 03] | National Institutes of Health: Report of the NCI- |
[NRC 06] | National Research Council of the National Academies: Health Risks from exposure to low levels of ionizing radiation – BEIR VII Phase 2. Board on Radiation Effects Research, Division on Earth and Life Studies, National Research Council of the National Academies, The National Academies Press, Washington, D.C., 2006 |
[Pie 03] | Pierce, D. A.; Sharp, G. B.; Mabuchi, M.: Joint effects of radiation and smoking on lung cancer risk among atomic bomb survivors. Radiat Res 159:511- |
[Pie 96] | Pierce, D. A.; Shimiza, Y.; Preston, D. L.; Vaeth, M.; Mabuchi, K.: Studies of the mortality of atomic bomb survivors. Report 12, Part I, Cancer. Radiat Res 146:1- |
[Pre 94] | Preston, D. L.; Kusumi, S.; Tomonaga, M. et al.: Cancer incidence in atomic bomb survivors. Part III: Leukemia, lymphoma and multiple myeloma, 1950- |
[Pre 02] | Preston, D. L.; Mattsson, A.; Holmberg, E.; Shore, R.; Hildreth, N. G.; Boice, J. D. Jr: Radiation effects on breast cancer risk: a pooled analysis of eight cohorts. Radiat Res 158:220- |
[Pre 03] | Preston, D. L.; Shimizu, Y.; Pierce, D. A.; Suyama, A.; Mabuchi, K.: Studies of mortality of atomic bomb survivors. Report 13: Solid cancer and noncancer disease mortality: 1950- |
[Pre 04] | Preston, D. L.; Pierce, D. A.; Shimizu, Y.; Cullings, H. M.; Fujita, S.; Funamoto, S.; Kodama, K.: Effect of recent changes in atomic bomb survivor dosimetry on cancer mortality risk estimates. Radiat Res 162:377- |
[Pre 07] | Preston, D. L.; Ron, E.; Tokuoka, S.; Funamoto, S.; Nishi, N.; Soda, M.; Mabuchi, K.; Kodama, K.: Solid cancer incidence in atomic bomb survivors: 1958- |
[Ron 95] | Ron, E.; Lubin, J. H.; Shore, R. E.; Mabuchi, K.; Modan, B.; Pottern, L. M.; Schneider, A. B.; Tucker, M. A.; Boice, J. D. Jr: Thyroid cancer after exposure to external radiation: a pooled analysis of seven studies, Radiat Res 141(3):259- |
[San 03] | dos Santos Silva, I.; Malveiro, F.; Jones, M. E.; Swerdlow, A. J.: Mortality after radiological investigation with radioactive thorotrast: a follow- |
[Schu 07] | Schubauer- |
[Shi 03] | Shilnikova, N. S.; Preston, D. L.; Ron, E.; Gilbert, E. S.; Vassilenko, E. K.; Romanov, S. A.; Kuznetsova, I. S.; Sokolnikov, M. E.; Okatenko, P. V.; Kreslov, V. V.; Koshurnikova, N. A.: Cancer mortality risk among workers at the Mayak Nuclear Complex. Radiat Res 159:787- |
[Tho 94] | Thomson, D. E.; Mabuchi, K.; Ron, E.; Soca, M.; Tokunaga, M.; Ochikubo, S.; Sugimoto, S.; Ikeda, T.; Teraski, M.; Preston, D. L.: Cancer incidence in atomic bomb survivors. Part II: Solid tumors, 1958- |
[Tra 03] | Travis, L. B.; Hauptmann, M.; Knudson Gaul, L.; Storm, H. H.; Goldman, M. B.; Nyberg, U.; Berger, E.; Janower, M. L.; Hall, P.; Monson, R. R.; Holm, L. E.; Land, C. E.; Schottenfeld, D.; Boice, J. D. Jr; Andersson, M.: Site- |
[UNSC 00] | United Nations Scientific Committee on the Effects of Atomic Radiation: Sources and Effects of ionizing radiation: UNSCEAR 2000 Report to the General Assembly, United Nations, New York, 2000 |
[UNSC 08] | United Nations Scientific Committee on the Effects of Atomic Radiation: Effects of ionizing radiation – UNSCEAR 2006 Report, Vol I. Report to the General Assembly, with scientific annexes A and B. United Nations sales publications. United Nations, New York, 2008 |
[Wan 02] | Wang, J. X.; Zhang, L. A.; Li, B. X.; Zhao, Y. C.; Wang, Z. Q.; Zhang, J. Y.; Aoyama, T.: Cancer incidence and risk estimation among medical x- |
[Win 05] | Wing, S.; Richardson, D. B.: Age at exposure to ionising radiation and cancer mortality among Hanford workers: follow up through 1994. Occup Environ Med 62:465- |
[Yii 05] | Yiin, J. H.; Schubauer- |
ANHANG 2:
Zusammenfassung der klinischen Erkenntnisse
1 Einleitung
Im Gegensatz zum anglo-amerikanischen Sprachgebrauch gibt es im Deutschen bei Unterschieden zwischen Männern und Frauen keine getrennten Begriffe, die widerspiegeln, ob die beobachteten Unterschiede auf das biologische Geschlecht (z.B. wegen unterschiedlicher Körpergröße, hormoneller Einflüsse etc.) oder das soziokulturelle Geschlecht zurückzuführen sind. Für letzteres wurde der Begriff des gender geprägt, der die kulturelle und soziale Rolle sowie die persönliche Identität, die dem Mann- bzw. Frausein attribuiert wird, umfasst. Im vorliegenden Kontext spielt gender vor allem in epidemiologischen Fragen, z.B. dem veränderten Rauchverhalten von Frauen und der Inzidenz des Lungenkarzinoms, eine Rolle bzw. für Aspekte der Krankheitsbewältigung (z.B. Schmerzerleben, Benennung von Symptomen) und die Inanspruchnahme medizinischer Versorgung.
Unterschiedliche Strahlenempfindlichkeit von Männern und Frauen könnte sich im Rahmen der Strahlentherapie auf das Ansprechen des Tumors und die Lokalkontrolle (d.h. Vermeiden von Rezidiven des Primärtumors) auswirken, aber auch auf unerwünschte frühe und späte Nebenwirkungen, einschließlich der Induktion von Zweitmalignomen. Trotz der Wichtigkeit der Thematik, auch in Hinblick auf Therapieentscheidungen, gibt es nur sehr wenige systematische Untersuchungen zum Einfluss des Geschlechts auf diese Endpunkte. Eine kürzlich veröffentlichte Auswertung von 661 prospektiven klinischen Studien zu Krebserkrankungen, die in besonders einflussreichen Fachzeitschriften veröffentlicht wurden, zeigte, dass Frauen generell in diesen Studien unterrepräsentiert waren [Jag 09].
2 Effektivität der Tumortherapie
Die Strahlenempfindlichkeit von Tumoren ist sehr unterschiedlich und führt zu sehr unterschiedlicher lokaler Kontrolle bei Strahlentherapie. Sie wird von zahlreichen Faktoren bedingt, vor allem der Tumorbiologie, aber auch von patientenspezifischen Faktoren wie Alter, Komorbidität und Geschlecht sowie von den zusätzlich eingesetzten Therapiemodalitäten (Chirurgie, Chemo- und Immunotherapie). Das Geschlecht wird ebenso wie Alter immer in die Analysen der lokalen Kontrolle und des Überlebens in Phase-II- und Phase-III-Studien miteinbezogen, aber spezifische Auswertungen zur Strahlenempfindlichkeit von Tumoren in Abhängigkeit vom Geschlecht liegen kaum vor.
Ein Einfluss des Geschlechts auf die Lokalkontrolle wird konsistenterweise beobachtet bei Hodgkin-Lymphomen, Weichteil-Sarkomen und Kopf-Halstumoren und zumindest teilweise beobachtet bei Krebserkrankungen von Lunge und Rektum, Ewing-Sarkomen, niedermalignen Gliomen und Meningiomen [Bor 09.]. Die beobachteten geschlechtsspezifischen Unterschiede können durch biologische Faktoren begründet sein, aber auch auf unterschiedliche Therapie und Therapiebereitschaft (compliance), psychosoziale Effekte etc. zurückführbar sein [Bor 09].
Eine wichtige und zunehmend gut untersuchte Rolle für geschlechtsspezifische Unterschiede im Ansprechen von Tumoren spielt die Empfindlichkeit gegenüber Chemotherapeutika. Zum Beispiel zeigten Singh et al. [Sin 05] für das kleinzellige Lungenkarzinom (SCLC) in einer Analyse an 1 000 Patienten aus Phase-II-Studien, dass Frauen sowohl eine erhöhte Toxizität bei vergleichbarer Chemotherapie als auch ein besseres Überleben nach Chemo- und Radiotherapie hatten. Allerdings scheinen Frauen per se eine günstigere Prognose als Männer zu haben, auch nach alleiniger Operation eines nicht-kleinzelligen Lungenkarzinoms (NSCLC) im Stadium I und II. Es ist ungeklärt, ob dies auch gilt, wenn die längere Lebenserwartung von Frauen und die geringere Häufigkeit an Komorbiditäten berücksichtigt wird [Ale 02, Bat 05, Bir 06, Cal 07, Chat 04, Fer 03, Foe 07, Moo 04, Oka 03, Rad 02, Vis 04]. Mit dem weiblichen Geschlecht sind weitere Faktoren verbunden, die das Ansprechen auf die Therapie und damit die lokale Kontrolle und das Überleben mitbestimmen können: Asiatische Frauen mit Adenokarzinomen der Lunge haben häufiger eine spezifische Mutation des EGFR-Gens (epidermal growth factor-receptor), die mit einem besseren Ansprechen auf Gefitinib, einem EGFR-Inhibitor, verbunden ist [Pao 04, Pae 04].
In einer Phase-III-Studie mit 1 700 Patienten zur adjuvanten Radiochemotherapie von Rektumkarzinomen war das weibliche Geschlecht ein unabhängiger, positiver Faktor für das Gesamtüberleben [Tep 02]. Wie auch in einer Meta-Analyse mehrerer vergleichbarer Studien nachgewiesen, zeigten Frauen eine erhöhte Toxizität nach Chemotherapie, vor allem mit 5-Fluorouracil , was auf eine erhöhte biologische Wirksamkeit der Chemotherapie hinwies. Dies führte möglicherweise zu einem verbesserten Gesamtüberleben [Chan 05]. In der Langzeitanalyse des Swedish Rectal Cancer Trial hatten Frauen ein besseres krankheitsspezifisches 13-Jahresüberleben (41 vs. 30%, p=0,001) und Gesamtüberleben (74 vs. 62%, p=0,004), unabhängig davon, ob sie eine Bestrahlung erhalten hatten oder nicht [Fol 05]. Die Lokalrezidiv- und Fernmetastasierungsrate war für Männer und Frauen gleich bei gleicher Verteilung von Tumorstadium und -lokalisation. In einer deutschen Multizenter-Studie zur prä- versus postoperativen adjuvanten Radiochemotherapie des Rektumkarzinoms zeigte sich, dass Männer häufiger als Frauen eine zeit- und dosisgerechte Strahlentherapie erhielten [Fie 07]. Die Gründe hierfür sind retrospektiv nicht für alle Patienten zu klären. Eine postoperativ erhöhte Darmtoxizität trug in einigen Fällen zu verzögerter Applikation der Radiochemotherapie bei. Jüngeres Alter der Patienten, behandelndes Zentrum und Therapieschema waren mit einer adäquaten Therapie verbunden. Eine inadäquate Therapie war mit einer erhöhten Lokalrezidivrate (21,2% ± 5,6 vs. 6,8% ± 1,4, p=0,0001) und verkürztem krankheitsspezifischem Überleben (57,4% ± 6,3 vs. 69,1% ± 2,3, p=0,02) in dieser post hoc-Analyse verbunden. In den weiteren Phase-III-Studien zur adjuvanten Radio- oder Radiochemotherapie wurde der Einfluss des Geschlechts nicht untersucht/nicht mitgeteilt [MRC 96, SRCT 97, Bos 06, Buj 06, Dah 90, Ger 06, Kap 01, Sau 04, Seb 09] oder war nicht nachweisbar [Tve 97].
3 Unerwünschte Folgen der Strahlentherapie
Es gibt einige wenige klinische Hinweise auf eine geschlechtsspezifisch unterschiedliche Strahlenempfindlichkeit der Normalgewebe. Eine Übersicht geben [Bor 09]. Eine definitive Aussage über das Vorhandensein oder Fehlen geschlechtsspezifischer unerwünschter Strahlenwirkungen ist aus mehreren methodischen Gründen schwierig. Die Dokumentation unerwünschter Strahlenwirkungen an sich ist nicht optimal [Ben 07, Sch 06]. Klinische Studien berichten diese häufig nur als krude Inzidenz, häufig mit nicht validierten bzw. nicht für die Strahlentherapie geeigneten Klassifikationen und selten über einen für die Erfassung von Spätfolgen ausreichend langen Zeitraum. Da die Strahlentherapie so dosiert wird, dass mittel/schwerwiegende unerwünschte Folgen mit einer Wahrscheinlichkeit von ≤ 5% auftreten und da in der Regel Kofaktoren, z.B. zusätzliche Therapiemodalitäten, Alter der Patienten, Komorbidität zu berücksichtigen sind, ist die Erfassung eines möglichen geschlechtsspezifischen Unterschiedes in der Strahlenreaktion nur in großen und standardisiert behandelten Kollektiven möglich.
Für die Entwicklung einer Katarakt nach primärer Strahlentherapie von Orbitalymphomen war das Geschlecht der einzige Risikofaktor mit einem deutlich höheren Risiko für Männer [Bha 02a]. Auch für die Myelopathie der Cauda equina nach kombinierter Photonen-Protonen-Therapie wurde eine geschlechtsspezifische Anhängigkeit gefunden. Für die Toleranzdosis TD 5/5, welche die Dosis angibt, bei der nach 5 Jahren bereits bei 5% der Patienten eine entsprechende Nebenwirkung auftritt, ergab sich für Männer ein signifikant niedriger Wert (p =0,017) [Pie 06]. Einen ähnlichen Effekt zeigte dieselbe Arbeitsgruppe für das Risiko einer Leukenzephalopathie in einer Dosisfindungsstudie zur Bestrahlung von Chordomen und Chondrosarkomen der Schädelbasis. Auch unter Berücksichtigung der Beziehung der Leukenzephalopathie zu Alter, Tumorvolumen, Diagnose-Verfahren und Bestrahlungsdosis war das Geschlecht der Patienten der einzige signifikante Risikofaktor (univariat, p=0,0155) [San 98].
In einer prospektiven Studie, in der die akuten Folgen der Radiotherapie bei Kopf-Hals-Tumoren bei 149 Patienten erfasst wurden, wurden für die meisten Nebenwirkungen wie Mukositis, Schluckbeschwerden sowie Speichelentwicklung keine Unterschiede gefunden. Lediglich hinsichtlich der Schmerzempfindungen ergaben sich für Frauen höhere Werte [Pal 08].
Wie bereits erwähnt, haben gezielte Untersuchungen an großen Studienkollektiven gezeigt, dass es geschlechtsspezifische Unterschiede in der Toxizität von einigen Chemotherapeutika gibt, die auf eine unterschiedliche Pharmakokinetik zurückgeführt werden [Chan 05, Gan 04, Mar 06, Rou 02, Sin 05]. Frauen haben z.B. stärkere und häufigere Reaktionen auf 5-Fluorouracil und Cisplatin, die häufig in kombinierter Radiochemotherapie für Rektumkarzinom und Lungenkarzinom eingesetzt werden. Diese erhöhte Toxizität kann dazu beigetragen haben, dass in einer Gruppe von 48 Patienten mit Analkarzinom die Leukopenie nach Radiochemotherapie mit dem weiblichen Geschlecht, Body Mass Index, durchstrahltem Knochenmarksvolumen und Lymphknotenmetastasierung assoziiert war [Mel 07].
4 Zweitmalignome nach Strahlentherapie
Überlebende von Krebserkrankungen haben im Vergleich zu Personen ohne vorherige Krebserkrankung ein erhöhtes Risiko, an einem neuen Tumor zu erkranken. Neben genetischen Faktoren und Einflüssen des Lebensstils kann die Therapie der Ersterkrankung ursächlich für das erhöhte Risiko sein. Aufgrund der großen Patientenzahlen sind Studien zu Zweittumoren, die auf bevölkerungsbasierten Tumorregistern beruhen, besonders aussagekräftig in Hinblick auf die Beschreibung von Einflussfaktoren wie Latenzzeit, Geschlecht, Alter bei der Ersterkrankung und Alter bei Diagnose der Zweiterkrankung [Tra 06]. Allerdings sind die therapiebezogenen Informationen in diesen Studien meist limitiert. Für Patientenkohorten aus klinischen Studien sind im Gegensatz dazu meist detaillierte Therapieinformationen verfügbar, aber die Probandenzahlen sind in diesem Fall oft limitiert.
Überlebende von Krebserkrankungen im Kindesalter sind im Hinblick auf das Auftreten von Zweittumoren besonders gut untersucht (s. Übersicht bei [Bha 02b, Rob 09]). Ihr Risiko ist gegenüber dem der allgemeinen Bevölkerung etwa 5-fach erhöht. Das weibliche Geschlecht wird allgemein mit einem erhöhten Risiko assoziiert, was besonders auf das häufige Vorkommen von sekundären Brustkrebserkrankungen nach Strahlentherapie von Hodgkin-Lymphom-Erkrankungen zurückzuführen ist [Bha 02b]. Allerdings finden Constine et al. (Con 08) in einer Studie an 930 Personen, die im Kindesalter an Hodgkin-Lymphom erkrankt waren, dass das Standardisierte Inzidenz Ratio nicht nur für alle Zweittumor-Entitäten zusammen bei Frauen deutlich größer ist als bei Männern (SIR=19,93 vs. SIR=8,41), sondern dass auch nach Ausschluss von Brustkrebserkrankungen ein erhöhtes Risiko für Frauen besteht (SIR=15,4). Ähnliches berichten Bluhm et al. [Blu 08] über 1 082 Überlebende einer Non-Hodgkin-Lymphom-Erkrankung im Alter unter 21 Jahren: Das Standardisierte Inzidenz Ratio für solide Zweittumoren war für Frauen deutlich höher als für Männer (SIR=6,9 [95%-KI: 3,9; 10,8] vs. SIR=2,3 [95%-KI: 1,1; 4,3]) und blieb auch erhöht, wenn Brusttumoren ausgeschlossen wurden (SIR=6,4 [95%-KI: 3,3; 11,1]).
Inskip und Mitarbeiter [Ins 2007] beobachteten an ca. 26 000 im Alter bis 18 Jahren krebserkrankten Kindern und Heranwachsenden (Diagnosezeitraum 1988-2002) ähnliche Zweittumor-Risiken für Frauen (O/E=5,9) und Männer (O/E=6,0). Wurde im Rahmen der Ersttherapie eine Strahlenbehandlung durchgeführt, erhöhte sich das Risiko gegenüber Patienten, die keine Strahlentherapie erhielten (RR=1,9, 95%-KI: 1,5; 2,5). Die Autoren führten jedoch keine nach Geschlechtern getrennte Auswertung des Risikos nach Strahlentherapie durch.
Viele der an Erwachsenen durchgeführten Studien zu Zweittumor-Erkrankungen nach Strahlentherapie betreffen geschlechtsspezifische Tumoren (z.B. Testes, Zervix, Mamma) und sind daher für einen Geschlechtervergleich nicht geeignet. Eine Auswertung des klinischen Krebsregisters des Landes Brandenburg [Til 09] zeigt, dass die generelle Zweittumor-Rate für Männer deutlich höher liegt als für Frauen. Da jedoch auch das Ersterkrankungsrisiko für Männer höher ist, ergeben sich für Frauen höhere Zweittumor-Risiken als für Männer (SIR=1,5 (95%-KI: 1,45; 1,59) vs. SIR=1,3 (95%-KI: 1,28; 1,39)). Unter den Patienten, die im Rahmen der Primärtherapie bestrahlt wurden, sind die Risiken vergleichbar mit denen des Gesamtkollektivs (SIR=1,6 [KI: 1,48; 1,72] bei Frauen und SIR=1,3 [KI: 1,13; 1,36] bei Männern), so dass kein Einfluss der Strahlentherapie sichtbar wird. Allerdings war die mediane Beobachtungszeit dieser Studie mit vier Jahren deutlich zu kurz.
Eine der wenigen Studien, die strahlenassoziierte Zweittumor-Risiken geschlechtsspezifisch untersuchte, wurde von Boukheris [Bou 08] durchgeführt. Die Autoren untersuchten das mit Strahlentherapie assoziierte Auftreten von Speicheldrüsenkarzinomen unter ca. 21 000 Überlebenden (≥ 1 Jahr Überlebenszeit) einer Hodgkin-Lymphom-(HL)-Erkrankung. Patienten, die mit Strahlentherapie behandelt wurden, zeigten ein signifikant höheres Risiko für ein Speicheldrüsenkarzinom als Patienten, die nicht bestrahlt wurden (O/E=16,9 [95%-KI: 10,4; 25,8] vs. O/E=4,8 [95%-KI: 1,31; 12,29]). Unter den am Speicheldrüsenkarzinom erkrankten Strahlenexponierten waren 2/3 weiblich, obwohl das Spontanrisiko für Männer deutlich höher ist als für Frauen, was auf ein erhöhtes strahlenbezogenes Risiko der Frauen hinweist. Diese Ergebnisse stehen allerdings im Widerspruch zu den Ergebnissen einer multinationalen Studie an HL-Überlebenden [Dor 02], den Ergebnissen der Life-Span Study [Pre 07] und den Ergebnissen einer Studie an Kindern, die wegen gutartiger Erkrankungen im Kopf-Hals-Bereich bestrahlt wurden [Schn 98], wo jeweils keine geschlechtsspezifischen Unterschiede für das Auftreten von Speicheldrüsenkarzinomen beobachtet wurden.
Mehrere Studien machen Angaben zu Zweittumor-Risiken in Abhängigkeit vom Geschlecht und in Abhängigkeit von der Therapiemodalität (bestrahlt vs. unbestrahlt), aber keine Aussage zu möglichen geschlechtsspezifischen Unterschieden unter den bestrahlten Patienten. Beispielsweise analysierten Tward und Mitarbeiter das Auftreten von Zweittumoren an ca. 78 000 Patienten, die zwischen 1973 und 2001 gegen Non-Hodgkin-Lymphom behandelt wurden [Twa 06]. Nach ihrer Erhebung haben männliche und weibliche NHL-Überlebende ähnlich erhöhte Risiken, Zweittumoren zu entwickeln (O/E=1,15 für Männer und O/E=1,12 für Frauen). Strahlentherapie hatte in dieser Studie keinen signifikanten Einfluss auf das Risiko (O/E=1,18 [95%-KI 1,12; 1,23] für Bestrahlte vs. O/E=1,13 [95%-KI 1,10; 1,17] für Unbestrahlte). In einer kleineren Studie an 563 Überlebenden einer NHL-Erkrankung [Sac 08] wurde hingegen ein signifikant erhöhtes Risiko für männliche Patienten (SIR=2,72 [1,76; 4,06]) gegenüber weiblichen Patienten (SIR=1,10 [0,50; 2,10]) beobachtet, aber kein signifikanter Einfluss einer erfolgten Strahlentherapie (SIR=2,48 [0,91; 5,40] mit Strahlentherapie vs. SIR=1,88 [1,25; 2,71] ohne Strahlentherapie).
Brown und Mitarbeiter [Bro 08] untersuchten das Auftreten von Zweittumoren in über 30 000 Überlebenden einer Schilddrüsenkrebserkrankung (Diagnosezeitraum 1973-2002). Das relative Risiko für Zweittumoren war unter den mit Radioisotopen behandelten höher als unter den nicht so behandelten Patienten (RR=1,10 [1,05; 1,27]; p< 0,05). Allgemein hatte das Geschlecht keinen Einfluss auf das Risiko, an Zweittumoren zu erkranken (O/E=1,09 für Männer und Frauen), aber die Kombination beider Parameter wurde nicht untersucht.
Literatur
[Ale 02] | Alexiou, C; Onyeaka, C. V.; Beggs, D.; Akar, R.; Beggs, L.; Salama, F. D.; Duffy, J. P.; Morgan, W. E.: Do women live longer following lung resection for carcinoma? Eur J Cardiothorac Surg 21:319- |
[Bat 05] | Batevik, R.; Grong, K.; Segadal, L.; Stangeland, L.: The female gender has a positive effect on survival independent of background life expectancy following surgical resection of primary non- |
[Ben 07] | Bentzen, S. M.; Trotti, A.: Evaluation of early and late toxicities in chemoradiation trials. J Clin Oncol 25:4096- |
[Bha 02a] | Bhatia, S.; Paulino, A. C.; Buatti, J. M.; Mayr, N. A.; Wen, B. C.: Curative radiotherapy for primary orbital lymphoma. Int J Radiat Oncol Biol Phys 54:818- |
[Bha 02b] | Bhatia, S.; Sklar, C.: Second cancers in survivors of childhood cancer. Nat Rev Cancer 2(2):124- |
[Bir 06] | Birim, O.; Kappetein, A. P.; van Klaveren, R. J.; Bogers, A. J.: Prognostic factors in non- |
[Blu 08] | Bluhm, E. C.; Ronckers, C.; Hayashi, R. J.; Neglia, J. P.; Mertens, A. C.; Stovall, M.; Meadows, A. T.; Mitby, P. A.; Whitton, J. A.; Hammond, S.; Barker, J. D.; Donaldson, S. S.; Robison, L. L.; Inskip, P. D.: Cause- |
[Bor 09] | Borgmann, K.; Dikomey, E.; Petersen, C.; Feyer, P.; Hoeller, U.: Sex- |
[Bos 06] | Bosset, J. F.; Collette, L.; Calais, G.; Mineur, L.; Maingon, P.; Radosevic- |
[Bou 08] | Boukheris, H.; Ron, E.; Dores, G. M.; Stovall, M.; Smith, S. A.; Curtis, R. E.: Risk of radiation- |
[Bro 08] | Brown, A. P.; Chen, J.; Hitchcock, Y. J.; Szabo, A.; Shrieve, D. C.; Tward, J. D.: The risk of second primary malignancies up to three decades after the treatment of differentiated thyroid cancer. J Clin Endocrinol Metab 93(2):504- |
[Buj 06] | Bujko, K.; Nowacki, M. P.; Nasierowska- |
[Cal 07] | Caldarella, A.; Crocetti, E.; Comin, C. E.; Janni, A.; Pegna, A. L.; Paci, E.: Gender differences in non- |
[Chan 05] | Chansky, K.; Benedetti, J.; Macdonald, J. S.: Differences in toxicity between men and women treated with 5- |
[Chat 04] | Chatkin, J. M.; Abreu, C. M.; Fritscher, C. C.; Wagner, M. B.; Pinto, J. A.: Is there a gender difference in non- |
[Con 08] | Constine, L. S.; Tarbell, N.; Hudson, M. M.; Schwartz, C.; Fisher, S. G.; Muhs, A. G.; Basu, S. K.; Kun, L. E.; Ng, A.; Mauch, P.; Sandhu, A.; Culakova, E.; Lyman, G.; Mendenhall, N.: Subsequent malignancies in children treated for Hodgkin's disease: associations with gender and radiation dose. Int J Radiat Oncol Biol Phys 72(1):24- |
[Dah 90] | Dahl, O.; Horn, A.; Morild, I.; Halvorsen, J. F.; Odland, G.; Reinertsen, S.; Reisaeter, A.; Kavli, H.; Thunold, J.: Low- |
[Dor 02] | Dores, G. M.; Metayer, C.; Curtis, R. E.; Lynch, C. F.; Clarke, E. A.; Glimelius, B.; Storm, H.; Pukkala, E.; van Leeuwen, F. E.; Holowaty, E. J.; Andersson, M.; Wiklund, T.; Joensuu, T.; van't Veer, M. B.; Stovall, M.; Gospodarowicz, M.; Travis, L. B.: Second malignant neoplasms among long- |
[Fer 03] | Fernandes, O. J.; Almgren, S. O.; Thaning, L.; Filbey, D.; Helsing, M.; Karlsson, M.; Magnusson, A.; Souza, D.: Prognostic factors for the survival of surgically treated patients for non- |
[Fie 07] | Fietkau, R.; Rodel, C.; Hohenberger, W.; Raab, R.; Hess, C.; Liersch, T.; Becker, H.; Wittekind, C.; Hutter, M.; Hager, E.; Karstens, J.; Ewald, H.; Christen, N.; Jagoditsch, M.; Martus, P.; Sauer, R.: Rectal cancer delivery of radiotherapy in adequate time and with adequate dose is influenced by treatment center, treatment schedule, and gender and is prognostic parameter for local control: results of study. CAO/ARO/AIO- |
[Foe 07] | Foegle, J.; Hedelin, G.; Lebitasy, M. P.; Purohit, A.; Velten, M.; Quoix, E.: Specific features of non- |
[Fol 05] | Folkesson, J.; Birgisson, H.; Pahlman, L.; Cedermark, B.; Glimelius, B.; Gunnarsson, U.: Swedish Rectal Cancer Trial: long lasting benefits from radiotherapy on survival and local recurrence rate. J Clin Oncol 23:5644- |
[Gan 04] | Gandhi, M.; Aweeka, F.; Greenblatt, R. M.; Blaschke, T. F.: Sex differences in pharmacokinetics and pharmacodynamics. Annu Rev Pharmacol Toxicol 44:499- |
[Ger 06] | Gerard, J. P.; Conroy, T.; Bonnetain, F.; Bouche, O.; Chapet, O.; Closon- |
[Ins 07] | Inskip, P. D.; Curtis, R. E.: New malignancies following childhood cancer in the United States, 1973- |
[Jag 09] | Jagsi, R.; Motomura, A. R.; Amarnath, S.; Jankovic, A.; Sheets, N.; Ubel, P. A.: Under- |
[Kap 01] | Kapiteijn, E.; Marijnen, C. A.; Nagtegaal, I. D.; Putter, H.; Steup, W. H.; Wiggers, T.; Rutten, H. J.; Pahlman, L.; Glimelius, B.; van Krieken, J. H.; Leer, J. W.; van de Velde, C. J.: Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 345:638- |
[Mar 06] | Marosi, C.: Gender aspects of treatment and drug related toxicity in medical oncology. Wien Med Wochenschr 156:534- |
[Mel 07] | Mell, L. K.; Schomas, D. A.; Salama, J. K.; Devisetty, K.; Aydogan, B.; Miller, R. C.; Jani, A. B.; Kindler, H. L.; Mundt, A. J.; Roeske, J. C.; Chmura, S. J.: Association Between Bone Marrow Dosimetric Parameters and Acute Hematologic Toxicity in Anal Cancer Patients Treated with Concurrent Chemotherapy and Intensity- |
[Moo 04] | Moore, R.; Doherty, D.; Chamberlain, R. and Khuri, F.: Sex differences in survival innon- |
[MRC 96] | Medical Research Council Rectal Cancer Working Party: Randomised trial of surgery alone versus radiotherapy followed by surgery for potentially operable locally advanced rectal cancer. Lancet 348:1605- |
[Oka 03] | Okada, M.; Nishio, W.; Sakamoto, T.; Harada, H.; Uchino, K.; Tsubota, N.: Longterm survival and prognostic factors of five- |
[Pae 04] | Paez, J. G.; Janne, P. A.; Lee, J. C.; Tracy, S.; Greulich, H.; Gabriel, S.; Herman, P.; Kaye, F. J.; Lindeman, N.; Boggon, T. J.; Naoki, K.; Sasaki, H.; Fujii, Y.; Eck, M. J.; Sellers, W. R.; Johnson, B. E.; Meyerson, M.: EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science 304:1497- |
[Pal 08] | Palazzi, M.; Tomatis, S.; Orlandi, E.; Guzzo, M.; Sangalli, C.; Potepan, P.; Fantini, S.; Bergamini, C.; Gavazzi, C.; Licitra, L.; Scaramellini, G.; Cantu, G.; Olmi, P.: Effects of Treatment Intensification on Acute Local Toxicity During Radiotherapy for Head and Neck Cancer: Prospective Observational Study Validating CTCAE, Version 3.0, Scoring System. Int J Radiat Oncol Biol Phys 70:330- |
[Pao 04] | Pao, W.; Miller, V.; Zakowski, M.; Doherty, J.; Politi, K.; Sarkaria, I.; Singh, B.; Heelan, R.; Rusch, V.; Fulton, L.; Mardis, E.; Kupfer, D.; Wilson, R.; Kris, M.; Varmus, H.: EGF receptor gene mutations are common in lung cancers from "never smokers" and are associated with sensitivity of tumors to gefitinib and erlotinib. Proc Natl Acad Sci USA 101:13306- |
[Pie 06] | Pieters, R. S.; Niemierko, A.; Fullerton, B. C.; Munzenrider, J. E.: Cauda equina tolerance to high- |
[Pre 07] | Preston, D. L.; Ron, E.; Tokuoka, S. et al. : Solid cancer incidence in atomic bomb survivors: 1958- |
[Rad 02] | Radzikowska, E.; Glaz, P.; Roszkowski, K.: Lung cancer in women: age, smoking, histology, performance status, stage, initial treatment and survival. Population- |
[Rob 09] | Robison, L. L.; Armstrong, G. T.; Boice, J. D.; Chow, E. J.; Davies, S. M.; Donaldson, S. S.; Green, D. M.; Hammond, S.; Meadows, A. T.; Mertens, A. C.; Mulvihill, J. J.; Nathan, P. C.; Neglia, J. P.; Packer, R. J.; Rajaraman, P.; Sklar, C. A.; Stovall, M.; Strong, L. C.; Yasui, Y.; Zeltzer, L. K.: The Childhood Cancer Survivor Study: a National Cancer Institute- |
[Rou 02] | Rousseau, A.; Marquet, P.: Application of pharmacokinetic modelling to theroutine therapeutic drug monitoring of anticancer drugs. Fundam Clin Pharmacol 16:253- |
[Sac 08] | Sacchi, S.; Marcheselli, L.; Bari, A.; Marcheselli, R.; Pozzi, S.; Luminari, S.; Lombardo, M.; Buda, G.; Lazzaro, A.; Gobbi, P. G.; Stelitano, C.; Morabito, F.; Quarta, G.; Brugiatelli, M.: Secondary malignancies after treatment for indolent non- |
[San 98] | Santoni, R.; Liebsch, N.; Finkelstein, D. M.; Hug, E.; Hanssens, P.; Goitein, M.; Smith, A. R.; O'Farrell, D.; Efird, J. T.; Fullerton, B.; Munzenrider, J. E.: Temporal lobe (TL) damage following surgery and high- |
[Sau 04] | Sauer, R.; Becker, H.; Hohenberger, W.; Rodel, C.; Wittekind, C.; Fietkau, R.; Martus, P.; Tschmelitsch, J.; Hager, E.; Hess, C. F.; Karstens, J. H.; Liersch, T.; Schmidberger, H.; Raab, R.: Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 351:1731- |
[Sch 06] | Scharf, O.; Colevas, A. D.: Adverse event reporting in publications compared with sponsor database for cancer clinical trials. J Clin Oncol 24:3933- |
[Schn 98] | Schneider, A. B.; Lubin, J.; Ron, E.; Abrahams, C.; Stovall, M.; Goel, A.; Shore- |
[Seb 09] | Sebag- |
[Sin 05] | Singh, S.; Parulekar, W.; Murray, N.; Feld, R.; Evans, W. K.; Tu, D.; Shepherd, F. A.: Influence of sex on toxicity and treatment outcome in small- |
[SRCT 97] | Swedish Rectal Cancer Trial: Improved survival with preoperative radiotherapy in resectable rectal cancer. N Engl J Med 336:980- |
[Tep 02] | Tepper, J. E.; O'Connell, M.; Niedzwiecki, D.; Hollis, D. R.; Benson, A. B. 3rd; Cummings, B.; Gunderson, L. L.; Macdonald, J. S.; Martenson, J. A.; Mayer, R. J.: Adjuvant therapy in rectal cancer: analysis of stage, sex, and local control – final report of intergroup 0114. J Clin Oncol 20:1744- |
[Til 09] | Tillack, A.: Zum Risiko eines Zweitmalignoms bei Krebskranken anhand der Daten des klinischen Krebsregisters des Tumorzentrums Land Brandenburg. Dissertation, Medizinische Fakultät, Charite– Universitätsmedizin Berlin, 19.08.2009 |
[Tra 06] | Travis, L. B.: The epidemiology of second primary cancers. Cancer Epidemiol, Biomarkers Prev 15(11):2020- |
[Tve 97] | Tveit, K. M.; Guldvog, I.; Hagen, S.; Trondsen, E.; Harbitz, T.; Nygaard, K.; Nilsen, J. B.; Wist, E.; Hannisdal, E.: Randomized controlled trial of postoperative radiotherapy and short- |
[Twa 06] | Tward, J. D.; Wendland, M. M.; Shrieve, D. C.; Szabo, A.; Gaffney, D. K.: The risk of secondary malignancies over 30 years after the treatment of non- |
[Vis 04] | Visbal, A. L.; Williams, B. A.; Nichols, F. C, 3rd; Marks, R. S.; Jett, J. R.; Aubry, M. C.; Edell, E. S.; Wampfler, J. A.; Molina, J. R.; Yang, P.: Gender differences in non- |
ANHANG 3:
Zusammenfassung der biologischen Erkenntnisse
1 Genetische und molekulare Basis der Geschlechtsbestimmung
- 1.1
- Geschlechtschromosomen beim Menschen
Beim Menschen, wie überhaupt bei Säugetieren, wird das Geschlecht durch die so genannten Geschlechtschromosomen festgelegt und vererbt. Im weiblichen Organismus gibt es zwei X-Chromosomen, im männlichen Organismus ein X- und ein Y-Chromosom. Die beiden Geschlechtschromosomen unterscheiden sich in ihrer Größe, Struktur sowie Zahl und Art der Gene. Beim Menschen ist das X-Chromosom ca. 160 Mb groß und enthält über 1 000 Gene, während das Y-Chromosom ca. 65 Mb groß ist und nur ca. 100 Gene enthält. Diese Gene befinden sich überwiegend in einem euchromatischen3 Bereich (ca. 25 Mb), der den kurzen und Teile des langen Chromsomenarms umfasst; der lange Arm enthält zudem einen sehr großen heterochromatischen, genfreien Sequenzblock. An den Chromosomenenden (nahe den Telomeren) finden sich die sog. pseudo-autosomalen Regionen (PAR1 und PAR2), die auf dem X- und dem Y-Chromosom gleich sind und Rekombination zwischen beiden Chromosomen erlauben. In den restlichen Bereichen des X- und Y-Chromosoms gibt es mosaikartig Sequenzen, die vom gemeinsamen „autosomalen Vorfahren4“ stammen und sich daher ähnlich sind, und solche, die X- bzw. Y-spezifisch sind [Ska 03, Ros 05].
- 1.2
- Y-Chromosom-spezifische Gene
Die Y-spezifischen Gene werden bevorzugt oder ausschließlich im Hodengewebe exprimiert und sind für die Spermiogenese und für die männliche Geschlechtsdifferenzierung von Bedeutung. Für die Festlegung des männlichen Geschlechts am wichtigsten ist das SRY-Gen (sex-determining region of Y). Für männliche Fruchtbarkeit (Spermiogenese) sind weitere Y-chromosomale Gene notwendig, die meist in mehrfacher Kopienzahl vorliegen und sich in Blöcken von 10 bis 100 kb in nahezu palindromischer Anordung finden; z.B. gibt es von TSPY (testis-specific protein Y) 35 Kopien.
- 1.3
- Geschlechtsdifferenzierung
Während der Embryogenese der Säugetiere entstehen zunächst „bipotentielle“ Gonaden und Reproduktionsorgane, deren Entwicklung in Richtung weiblich verläuft, falls kein aktives SRY-Protein vorliegt, das die Entwicklung in Richtung „männlich“ treibt. Das Gewebe der Gonaden besteht aus drei Zelltypen, und zwar den Vorläufern der eigentlichen Geschlechtszellen, den Nähr- und Stützzellen mit metabolischen Funktionen und den hormonproduzierenden Zellen. Nach der SRY-abhängigen Differenzierung zu männlichen und weiblichen Gonaden bilden sich in den männlichen Gonaden die Sertoli- und Leydig-Zellen aus, deren Hormone (Anti-Müller-Hormon bzw. Testosteron) der Unterdrückung phänotypisch weiblicher Strukturen dienen bzw. im Falle von Testosteron der Entwicklung phänotypisch männlicher Geschlechtsorgane. Ohne SRY-Protein entwickeln sich die Gonaden zu Eierstöcken, und in Abwesenheit von Testosteron und Anti-Müller-Hormon entwickeln sich die weiblichen Geschlechtsorgane aus den primordialen Reproduktionsorganen.
- 1.4
- Inaktivierung des X-Chromosoms
Männliche Säugetiere besitzen ein, weibliche hingegen zwei X-Chromosomen mit allen darauf liegenden Genen. Während der frühen embryonalen Entwicklung wird jedoch in den Zellen des weiblichen Embryos ein X-Chromosom genetisch „inaktiviert“, und zwar nach Regeln des Zufalls in manchen Zellen das vom Vater (paternale), in anderen Zellen das von der Mutter ererbte (maternale) X-Chromosom. Diese Inaktivierung wird dann über alle weiteren Zellteilungen weitergegeben. Die Folge der Inaktivierung ist die Bildung von hetero-chromatischen Barr-Körperchen, die aufgrund der starken Kondensation mikroskopisch sichtbar sind. Die überwiegende Zahl der Gene (80%) auf dem inaktivierten X-Chromosomen sind transkriptionell stillgelegt, und man findet alle epigenetischen Kennzeichen für transkriptionell inaktives Chromatin: Methylierung der DNA an den sog. CpG-Inseln (Regulationseinheiten im Promotor-Bereich kodierender Gene), reduzierte oder fehlende Acetylierung der Histone, für Heterochromatin typische Methylierungsmuster des Histons H3 und eine Sonderform des Histons H2A, macroH2A1. Eine Konsequenz der Heterochromatisierung ist die späte Replizierung des inaktivierten X-Chromosoms im Zellzyklus, während das aktive X-Chromosom früh in der S-Phase repliziert.
- 1.5
- Epigenetische Regulation der Inaktivierung des X-Chromosoms
Essentiell für die Inaktivierung des X-Chromosoms ist ein Zentromer-naher Bereich, der als X-Inactivation Center (XIC) bezeichnet wird. Wird dieser Bereich deletiert, unterbleibt die Inaktivierung des X-Chromosoms. In dem XIC-Bereich ist das Gen XIST lokalisiert, das speziell auf dem inaktivierten X-Chromosom exprimiert wird und das für das X inactive specific transcript kodiert. Das XIST-Transkript kodiert nicht für ein Protein; es gehört mit seiner Länge von ca. 17 kb zu der Klasse der sog. macro non-coding (nc) RNAs. In der frühen Embryogenese wird das XIST-Transkript von beiden X-Chromosomen exprimiert, später nur noch von dem inaktivierten X-Chromosom. Für die biologische Funktion der XIST ncRNA wird folgender Mechanismus postuliert: XIST ncRNA bindet an das X-Chromosom, so dass sich bei der Entstehung des inaktiven Zustandes eine Art von Gerüst bildet, an das sich Enzyme binden, z.B. solche, die Histon H3 an den Lysinen 9 und 27 methylieren (Histon-Methyltransferasen) und Histon H4 deacetylieren (Histon-Deacetylasen). Diese Mechanismen sind Teil der epigenetischen Regulation.
Die Inaktivierung eines der beiden X-Chromosomen ist zumindest für Mäuse ein essentieller Vorgang. Mausmutanten, bei denen die Inaktivierung unterbleibt, zeigen eine stark gestörte Embryogenese, was letztlich zum Tod des Embryos führt. Die X-Inaktivierung steht unter komplexer genetischer Kontrolle, die sich auch auf die Expression und die Stabilität der XIST ncRNA auswirkt. Störungen können dazu führen, dass paternales und maternales Chromosom nicht nach Regeln des Zufalls inaktiviert werden.
- 1.6
- Genomische Prägung (Genomic Imprinting)
Ein weiterer Fall epigenetischer Regulation ist die genomische Prägung, bei der paternale und maternale Gene (lokalisiert auf den Chromosomen, die väterlicher bzw. mütterlicher Herkunft sind) unterschiedlich exprimiert werden, obwohl sie die gleiche Nukleotid-Sequenz haben. Befruchtete Eizellen der Maus, die durch entsprechende Manipulation nur mütterliche oder nur väterliche Genome besitzen, sterben kurz vor oder nach der Implantation in die Uteruswand.
Es gibt im menschlichen Genom ca. 90 Gene, die in Clustern von 2 oder mehr Genen angeordnet sind, bei denen eine derartige von der elterlichen Herkunft abhängige Inaktivierung der Genexpression stattfindet. Auch beim Imprinting spielen epigenetische Mechanismen eine Rolle. Es sind zum einen ncRNAs unterschiedlicher Größe beteiligt, die entweder über Struktur-bildende Funktionen im Chromatin (wie XIST-Transkript) oder an die Transkription gekoppelt wirken. Zum anderen sind spezifische DNA-Regionen (Insulatoren) beteiligt, deren Methylierungsstatus je nach parentaler Herkunft unterschiedlich ist [ Pau 07].
Gene, die dem Imprinting unterliegen, sind funktionell haploid, d.h. nur eine der beiden Kopien ist aktiv. Daher fehlt ihnen der Schutz, den das Vorhandensein von zwei Kopien normalerweise bietet, indem eine Schädigung und Inaktivierung der einen Kopie durch die noch funktionelle zweite Kopie zumindest teilweise kompensiert werden kann. Frauen und Männer unterscheiden sich nicht hinsichtlich der Gene, die dem Imprinting unterliegen, oder deren Regulation. Bei DNA-Schäden in der Keimbahn könnten jedoch aufgrund des Imprintings die Folgen für die Nachkommen unterschiedlich sein, je nachdem ob die Keimbahn des Vaters oder der Mutter betroffen war.
(Details zu der gesamten Thematik in Kapitel 1 finden sich in dem Lehrbuch von R. Knippers [Kni 06]).
2 Problemstellung und mögliche experimentelle Ansätze
Epidemiologische Studien belegen eine für Frauen signifikant niedrigere spontane Tumorinzidenz als für Männer [ Rie 08]. Ebenfalls weisen epidemiologische Untersuchungen darauf hin, dass es geschlechtsspezifische Strahlensensibilität geben mag (siehe Anhang 1). Für biologische Studien, die die epidemiologischen Befunde untermauern sollen, sind geeignete Versuchsmodelle notwendig, mit denen bei ausreichendem Versuchsumfang die postulierte geschlechtsspezifische Strahlensensibilität eindeutig nachgewiesen werden kann. Außer möglicher genetischer und epigenetischer Kontrolle können auch andere Faktoren, insbesondere Hormone, einen Einfluss haben. Um diese vielfältigen Faktoren zu erfassen, bieten sich Tiermodelle an, bei denen die Tumorinzidenz und ggf. auch andere Endpunkte als Indikator für Strahlensensibilität analysiert werden können. Tatsächlich sind Mausmodelle erfolgreich etabliert worden, so dass die vielfältigen Analysen unter standardisierten Bedingungen ablaufen können (siehe Punkt 3.).
Um Informationen über die Mechanismen zu erhalten, die der postulierten geschlechts-spezifischen Strahlensensibilität zugrunde liegen, wurden neben den Tiermodellen auch Zellmodelle verwendet. Humanes peripheres Blut von gesunden Probanden wurde ebenso bestrahlt und analysiert wie humane Zelllinien oder Zellen ausgewählter Organe der Mausmodelle, die für den Nachweis der geschlechtsspezifischen Strahlensensibilität entwickelt und mit geeigneten Bestrahlungsprotokollen behandelt wurden. Untersucht wurden zelluläre Antworten auf Bestrahlung, wie DNA-Reparatur, Zelltod und unbegrenzte Proliferation sowie Genexpression [Bor 09].
Teilweise wurden gesamtgenomische Screening-Verfahren verwendet, wie z.B. Microarray-Studien zur Analyse der Genexpression (Quantifizierung der Transkript-Mengen), sowie verschiedene Techniken zur Analyse epigenetischer Regulationsmechanismen, wie z.B. der Methylierungsmuster von DNA und von Histonen, sowie der Expression von sogenannten microRNAs (miRNA). Die miRNAs sind endogene einzelsträngige RNA-Moleküle, die mit 19 bis 21 Nukleotiden im Gegensatz zu den oben erwähnten macro ncRNAs sehr kurz sind. Die miRNAs regulieren nach heutiger Kenntnis ca. 30% der Gene im Säugergenom. Durch ihre Sequenzhomologie lagern sich miRNAs an messenger RNAs (mRNA) an und verhindern deren Translation. Auf diese Weise kann die Expression von 10 bis 100 Genen gleichzeitig reguliert werden. Es wird vermutet, dass im menschlichen Genom Tausende von miRNAs exprimiert werden, aber bisher sind nur ca. 500 beschrieben (Übersichtsartikel [Mac 07, Tan 08, Gol 07]).
Epigenetische Regulationsfaktoren sind für die Thematik geschlechtsspezifischer Strahlensensibilität aus folgenden Aspekten sehr interessant. Es stellt sich die Frage, ob die beim Menschen durch ca. 90 Gene gesteuerte X-Inaktivierung oder auch Imprinting-Prozesse durch Strahlung oder andere genotoxische Agentien beeinflusst werden können. Tatsächlich gibt es sehr gute Evidenzen, dass niedrige, ggf. chronische Strahlendosen über epigenetische Mechanismen einen Einfluß auf die Genexpression ausüben [Kov 08b, Kov 08c]. Diese potentiellen Zusammenhänge sind bisher noch nicht untersucht worden.
3 Tiermodelle
Tiermodelle bestätigen und erweitern die Evidenz der epidemiologischen Studien. Zum Beispiel zeigten weibliche Mäuse (Stamm „Swiss“; bei Bestrahlung 3-4 Wochen alt) bei Ganzkörperbestrahlung mit einer Dosis von 3 Gy eine höhere Inzidenz von Lymphomen des Thymus (83%) als entsprechend behandelte männliche Mäuse (72%); auch war das Wachstum der Tumore in den weiblichen Mäusen aggressiver. Bei 12-13 Wochen alten Mäusen war der Unterschied wesentlich ausgeprägter: Während 74% der weiblichen Tiere Lymphome des Thymus entwickelten, waren es nur 14 % der männlichen Tiere [Dan 07], was auf den Einfluss des Hormonstatus hinweisen könnte. Auch lag die Inzidenz von Osteosarkomen nach Behandlung mit Th-227 (4 Gy) bei weiblichen Mäusen zwischen 25-60%, bei männlichen bei 10-30% [Mue 78]. Hingegen entwickelten männliche Mäuse nach chronischer UVB-Behandlung früher, zahlreicher und größere Plattenepithelkarzinome (SCC) der Haut mit schlechterer Prognose als weibliche Tiere [Tho 07]. Auch für die Empfindlichkeit gegen chemische Karzinogene sind in einer Meta-Analyse über 1 394 Studien geschlechtsspezifische Unterschiede für die Inzidenz organspezifischer Tumore nachgewiesen worden. So induzierten in der Ratte 25 verschiedene Chemikalien Nierentumore in männlichen Tieren, aber nur 9 Substanzen in weiblichen [Huf 91].
Sehr viele der nachstehend erwähnten Arbeiten für zelluläre und molekulare Analysen der geschlechtsspezifischen Strahlenwirkung wurden in der Gruppe von O. Kovalchuk unter standardisierten Bedingungen durchgeführt. Es wurde der Mäusestamm C57/BL6 verwendet; die Tiere waren je nach Versuch bei Bestrahlung 45 bis 60 Tage alt, hatten identisches Körpergewicht und wurden nach einheitlichen Protokollen bestrahlt. „Chronische“ Ganzkörper-Bestrahlung wurde durch 10malige Applikation von 5cGy/Tag Röntgenbestrahlung simuliert, während als akute Dosis 50 cGy am 10.Tag einmalig appliziert wurde. Kontrolltiere wurden entsprechend scheinbestrahlt [Bes 05, Cas 06, Iln 08, Iln 09, Tam 08b].
Dieselbe Gruppe hat zudem ein Bestrahlungsprotokoll entwickelt, um in vivo (im Ganztier) den so genannten Bystander5-Effekt zu untersuchen. Mäuse des Stammes C57/BL6 wurden unter Abschirmung des Körpers am Kopf mit 1 Gy bestrahlt (Kontrollen erhielten 1 Gy Ganzkörperbestrahlung), und es wurden die Effekte in der Milz analysiert [Kot 08a, Kot 08b, Kot 08c]. Ähnliche Versuche wurden auch mit der Ratte (Long Evans, 3 Monate alt) durchgeführt [Kot 07, Tam 08a].
4 Zelluläre Antworten auf Strahlung
Die zellulären Antworten auf Strahlung sind sehr komplex und beziehen eine Vielzahl von molekularen Prozessen ein, wie zum Beispiel (1) Änderungen der Genexpression, (2) Signaltransduktionsketten, die sowohl durch Schädigung der DNA als auch durch Konformationsänderungen von Rezeptoren in der Membran initiiert sein können, (3) Reparaturprozesse, durch die eine sehr große Zahl verschiedener DNA-Schäden entfernt oder funktionell toleriert werden, (4) Zellproliferation und (5) Antworten wie Zellzyklus-Arrest und programmierter Zelltod (Apoptose) (siehe zur Übersicht [SSK 08]). Prinzipiell könnten geschlechtsspezifische Unterschiede in diesen Prozessen und weitere physiologische Mechanismen, wie z.B. hormonelle Einflüsse und virale Infektionen, sowie ggf. auch Unterschiede im Lebensstil im Gesamtorganismus eine geschlechtsspezifische Reaktion auf Strahlung bedingen. Da an diesen vielfältigen Mechanismen eine sehr große Zahl von Genen beteiligt ist, erscheint der Einsatz von gesamt-genomischen Screening-Verfahren sinnvoll, diese wurden aber vermutlich wegen der hohen Kosten noch nicht häufig durchgeführt.
- 4.1
- Quantifizierung der Genexpression (Microarray-Studien)
Genexpression als Marker für interindividuelle Variation wurde sowohl in peripherem Blut, in Zellkulturen als auch in Tiermodellen mit Microarrays vielfach untersucht, und diese Verfahren haben zunehmend auch klinische Relevanz für das Design der Therapie [Whi 03, Mea 08]. Mögliche geschlechtsspezifische Unterschiede sind folglich nur einer von vielen Parametern der Auswertung. Whitney und Mitarbeiter [Whi 03] führten Genexpressionsanalysen mit Microarrays am peripherem Blut von 75 gesunden Probanden durch und
konnten geschlechtsspezifisch differentiell exprimierte Gene identifizieren. Während viele davon auf den X- bzw. Y-Chromosomen kodieren, wurde auch für einige autosomale Gene ein deutlicher geschlechtsspezifischer Bias beobachtet, z.B. für Gene, die eine Rolle für die Interferon-Antwort und möglicherweise für Autoimmunkrankheiten spielen. Meadows und Mitarbeiter [Mea 08] beschrieben spezifische Genexpressions-Profile, die es ermöglichen, bestrahlte Patienten (1,5 oder 2 Gy Ganzkörperbestrahlung zur Transplantations-Konditionierung) von unbestrahlten zu unterscheiden. In Studien mit Mäusen fanden diese Autoren zudem Hinweise, dass sich die für Strahlenexposition spezifischen Genexpressionsprofile bei Männchen und Weibchen in vielen Genen unterscheiden [Mea 08].
Es gibt weitere Studien, in denen Genexpressions-Profile in Antwort auf Strahlung in der Maus analysiert wurden, und zwar im Vergleich von akuter zu chronischer Bestrahlung im Niedrigdosis-Bereich [Bes 05, Kov 04]. In der Gruppe von Kovalchuk und Mitarbeitern wurde in dem im Kapitel 3 vorgestellten Mausmodell C57/BL6 die strahleninduzierte Genexpression nach akuter (50 cGy Ganzkörperdosis, einmalig appliziert) und chronischer (5 cGy Ganzkörperdosis pro Tag, über 10 Tage appliziert) Röntgenbestrahlung von männlichen und weiblichen Mäusen untersucht. Muskel-, Milz- und Lebergewebe wurden mit Hilfe von murinen Microarrays von Affimetrix analysiert und die Ergebnisse ausgewählter Kandidatengene mittels RT-PCR und Western Blot nachgeprüft. Es fand sich eine bemerkenswert große Anzahl statistisch belegter geschlechtsspezifischer Unterschiede bei den strahleninduzierten Änderungen der Genexpression, und zwar insbesondere bei Genen, die für Faktoren von Signalketten kodieren (Wachstumsfaktoren und deren Rezeptoren, zytoplasmatische Serin-/Threonin-Proteinkinasen, G-Proteine usw.), und bei Genen für Zell-Zell-Interaktionen. Signifikante Änderungen der Genexpression wurden häufiger in männlichen Geweben gefunden, und zwar sowohl bei akuter als auch chronischer Bestrahlung (Beispiele Smarcf, Cox6c), während in den weiblichen Mäusen meist nur geringe oder keine Änderungen nachweisbar waren. Anderseits wurde das Gen für den Transkriptions-Initiationsfaktor Eif1 in weiblichen Mäusen stark induziert (8-fach bei akuter und 10-fach bei chronischer Bestrahlung), während es in männlichen Mäusen deutlich herunterreguliert wurde [Kov 04]. Das Eif1-Gen in weiblichen Mäusen war jedoch auch ohne Bestrahlung erhöht exprimiert [Whi 03]. In einer weiteren Studie [Cas 06] mit einem ähnlichen Studiendesign, wie bei Kovalchuk et al. 2004 [Kov 04] beschrieben, wurde die in männlichen Mäusen deutlich erhöhte, aber in weiblichen Tieren signifikant verringerte Expression des RBBP9 Proteins (Retinoblastom-Bindeprotein 9) im Milzgewebe hinsichtlich ihrer Auswirkungen auf den Phosphorylierungsstatus des Retinoblastomproteins sowie auf Apoptose und Zellproliferation analysiert. Dabei wurden Unterschiede zwischen männlichen und weiblichen Tieren und auch zwischen akuter und chronischer Strahlung gefunden. Ein möglicher Bezug dieser Ergebnisse zur Problematik der geschlechtsspezifischen Strahlenempfindlichkeit des Menschen bleibt jedoch, wie bei den anderen gesamt-genomischen Analysen der Genexpression, offen, da bislang unklar ist, wie die genannten Expressionsänderungen die Tumorentstehung beeinflussen.
- 4.2
- Epigenetische Regulation der Genexpression
Epigenetische Regulation der Genexpression erfolgt (1) durch Methylierung der DNA an den sog. CpG-Inseln, d.h. lokal gehäufte Abfolgen von Cytidinen (C) und Guaninen (G) im Promotorbereich von Genen, (2) durch Modifizierung der Histone und (3) durch miRNA vermittelte Hemmung der Translation von Transkripten.
Hypomethylierung der CpG-Inseln führt zur Aktivierung und Hypermethylierung zur Stilllegung der Expression der zugehörigen Gene. Strahlung (wie auch viele andere Agenzien) bewirkt Änderungen im Methylierungsmuster und infolge dessen Änderungen in der Genexpression. In einem ähnlichen Studiendesign, wie es oben beschrieben ist, wurde nach chronischer Strahlenexposition bei weiblichen Mäusen eine stärkere Reduktion der gesamt-genomischen Methylierung als bei männlichen Tieren gefunden, die zusätzlich gewebeabhängig war [Kov 04, Pog 04, Sil 04]. Eine Korrelation zu der geschlechtsspezifischen Tumorinzidenz, die in epidemiologischen Studien aufgezeigt wird (siehe Kapitel 2 und Anhang 1), ist jedoch nicht offensichtlich. So ist die gesamt-genomische Methylierung in der Leber der weiblichen Maus signifikant höher als in der der männlichen [Pog 04]; laut Tabelle A4 und Tabelle A11 ist jedoch das ERR für strahleninduzierte Lebertumoren bei Mann und Frau gleich. Es ist auch hier zu vermerken, dass die Relevanz molekularer Parameter, wie Expressionsprofile von Genen oder gesamt-genomische Methylierungsmuster, für das Verständnis von Strahlensensibilität noch völlig ungeklärt ist. Als Probleme sind die unterschiedlichen Modellsysteme zu sehen, die in verschiedenen Gruppen verwendet werden, ggf. auch Unterschiede zwischen Mensch und Maus in ihren zellulären und organismischen Antworten auf Strahlung. Vor allem aber kennen wir die Bedeutung einzelner Gene für die Entstehung spontaner und strahleninduzierter Tumore noch nicht genügend.
MikroRNAs (miRNAs), kurze einzelsträngige nicht-kodierende RNAs, sind wichtige Regulatoren der Genexpression. Sie spielen ebenfalls eine Rolle bei der Embryogenese und Keimzellreifung, und es gibt zunehmend gute Evidenzen dafür, dass zelluläre miRNAs qualitativ und quantitativ durch genotoxischen Stress infolge von Chemikalien und Strahlen beeinflusst werden [Kot 08a, Kot 08c, Kov 08a]. Aber auch ihre Rolle bei der spontanen und strahleninduzierten Tumorgenese ist noch nicht genügend analysiert und demzufolge unverstanden.
- 4.3
- Signaltransduktion
Bei den gesamt-genomischen Genexpressions-Analysen ist offensichtlich, dass geschlechtsspezifisch exprimierte Proteine häufig dem Netzwerk der Signaltransduktion zuzuordnen sind [Bes 08, Kov 04]. Eine sehr wichtige Schlüsselfunktion in diesem Netzwerk hat der in der Membran lokalisierte Rezeptor für den epidermalen Wachstumsfaktor (epidermal growth factor; EGFR). Der EGFR ist verantwortlich für Antworten auf verschiedene Wachstumsfaktoren und auf exogene Stressfaktoren, wie z.B. Strahlung, sowie für die nachfolgende Regulation von Zellwachstum, Differenzierung und Zelltod. Überexpression des EGFR, wie häufig in Tumoren zu finden, führt bei kombinierter Strahlen- und Chemotherapie zur Resistenzbildung, die durch EGFR-Inhibitoren wieder aufgehoben werden kann [Rod 07]. Es sind Mutationen im EGFR-Gen bekannt, die bei Frauen häufiger auftreten als bei Männern (18,5% vs. 8,6%; p=0,0004) und die zu einem besseren Therapieerfolg der entsprechenden Personen führen [Bor 09, Pao 04, Bel 05]. Der EGFR-Rezeptor ist daher ein sehr gutes Beispiel dafür, dass molekulare Befunde zum verbesserten Verständnis der geschlechtsspezifischen Strahlenempfindlichkeit beitragen.
- 4.4
- DNA-Reparatur
Es ist allgemein anerkannt, dass strahleninduzierte DNA-Schäden, ihre Zahl sowie die Effizienz und Güte ihrer Reparatur wichtige Ursachen für die Entscheidung zwischen Zelltod und –überleben sind. Es liegt daher nahe, dass geschlechtsspezifische Strahlenempfindlichkeit eine Ursache in unterschiedlichen Mengen an DNA-Schäden und/oder unterschiedlich exprimierten Reparaturgenen und folglich in unterschiedlich effektiven Reparaturprozessen haben könnte. Die Datenlage ist jedoch sehr widersprüchlich und angesichts der zahlreichen Untersuchungen unbefriedigend. Im Gegensatz zu den deutlichen geschlechtsspezifischen Unterschieden der Expression von Genen der Signaltransduktion zeigten Genexpressions-Analysen von DNA-Reparaturgenen fast keine Unterschiede in der strahleninduzierten Expression im Muskelgewebe zwischen männlichen und weiblichen Mäusen [Kov 08c].
Für die Zahl der DNA-Schäden (Chromosomenbrüche, Mikrokerne, DNA-Brüche gemessen im Comet Assay sowie Doppelstrang-Brüche (DSB) gemessen mit γH2AX-Foci-Assay u.v.m.), die nach Bestrahlung von Mäusen und von menschlichen Zellen in Kultur mit Hilfe vieler unterschiedlicher Methoden analysiert wurden, war kein Trend für geschlechtsspezifische Unterschiede zu beobachten. Gründe mögen in der starken Heterogenität der Kollektive liegen, bei denen auf mögliche Einfluss-Faktoren (Confounder) wie Alter, Rauch- und Alkoholverhalten etc. keine Rücksicht genommen wurde [Jos 04, Kot 06a, Kot 06b, Maf 02, Maf 04, Mar 03, May 91, Mul 01, Pog 04, Sor 00, Thi 00, Wan 00]. Untersuchungen der Strahlenempfindlichkeit von menschlichen diploiden Fibroblasten unter standardisierten Bedingungen zeigten allerdings ebenfalls keine Geschlechtsunterschiede [Cox 80, Lit 88].
Hingegen zeigten UVB-behandelte männliche Mäuse signifikant mehr oxidative DNA-Schäden und geringere Mengen an Antioxidatien als weibliche Mäuse [Tho 07]. In Lymphozyten trächtiger Mäuse fanden sich erhöhte Zahlen an strahleninduzierten chromosomalen Brüchen [Ric 91]. Ähnliche Befunde gibt es für schwangere Frauen, für die eine Korrelation der Anzahl der Brüche mit der Konzentration an Schwangerschaftshormon (Progesteron) nachgewiesen wurde. Die Bruchrate ging nach der Geburt auf diejenige nicht-schwangerer Frauen zurück [Ric 97]. Frauen, die Östrogene nehmen, zeigten signifikant erhöhte Konzentrationen an Cortisol im Plasma, was zur Hemmung von DNA-Reparatur führte [O'Bri 93]. Diese Befunde geben einen Hinweis darauf, dass Geschlechtshormonen eine wichtige Rolle für das Verständnis geschlechtsspezifischer Strahlenempfindlichkeit zukommt (siehe auch Kapitel 5 und 6). Damit wird die bereits geäußerte Vermutung bestätigt, dass für die Problemstellung der geschlechtsspezifischen Strahlenempfindlichkeit Experimente am Tier notwendig sind. Es wäre auch verständlich, dass bei den oben erwähnten Experimenten mit Zellmodellen keine geschlechtsspezifischen Unterschiede in der Entstehung bzw. Reparatur von DNA-Schäden zu finden sind.
- 4.5
- Zellproliferation und Apoptose
In zwei Studien wurden menschliche Lymphozyten [Schm 03] und murine Zellen der Milz [Cas 06] bezüglich geschlechtsspezifischer Unterschiede in Apoptose und Zellproliferation nach Röntgenstrahlen analysiert. Beide Studien beschrieben eine höhere Empfindlichkeit für Apoptose in männlichen Probanden, die sich jedoch im Falle der Maus nicht auf das Proliferationsverhalten auswirkte [Cas 06]. UVB-Bestrahlung führte zu höheren Entzündungsraten bei weiblichen Mäusen als bei männlichen; da jedoch die Häufigkeit an Hautkrebs (Nicht-Melanome) bei männlichen Tieren signifikant höher war als bei weiblichen, spielt Entzündung offenbar keine Rolle für die Geschlechtsspezifität [Tho 07]. Auch hier ist wieder ein Beispiel dafür zu finden, dass die Befunde für unterschiedliche Endpunkte, hier Entzündung vs. Entstehung von Hauttumoren, widersprüchlich sind.
Zusammenfassend ist zu sagen, dass mit Hilfe moderner Screening-Verfahren eine große Zahl von Genen gefunden wurde, die in Reaktion auf Strahlung bei den Geschlechtern unterschiedlich exprimiert werden. Diese Kenntnisse erlauben gezielte Versuche, potentiell geschlechtsspezifische zelluläre Antworten auf Strahlen besser zu verstehen. Die zitierten Ergebnisse über zelluläre Funktionen wie Zellproliferation und -überleben, DNA-Reparatur
etc. erlauben allerdings viel weniger eindeutige Aussagen über Geschlechtsspezifität in der Strahlenantwort als die Genexpressions-Analysen, und sie sind teilweise sehr widersprüchlich.
5 Bystander-Effekt und geschlechtsspezifische Strahlenempfindlichkeit
Als Bystander-Effekt bezeichnet man die Kommunikation von strahleninduzierten Effekten in bestrahlten Zellen zu den nicht bestrahlten Zellen, die sich in deren Umgebung befinden und als Bystander-Zellen bezeichnet werden. In diesen unbestrahlten Zellen können eine Destabilisierung des Genoms und andere phänotypische Reaktionen auftreten, wie sie in direkt bestrahlten Zellen zu finden sind. Diese Bystander-Effekte sind in Zellkulturen, 3D-Zell-Modellen und inzwischen auch in vivo am Ganztier nachgewiesen worden. Kovalchuk und ihre Mitarbeiter haben Maus- und Rattenmodelle entwickelt, bei denen nach lokaler Bestrahlung des Kopfes mit Röntgenstrahlen die Bystander-Effekte in den von Strahlung abgeschirmten Keimdrüsen und in den Nachkommen sowie insbesondere in der Milz nachgewiesen werden können [Kot 06a, Kot 07, Kot 08a, Kot 08c, Iln 08]. Offenbar hat die Milz eine Schlüsselposition für den Bystander-Effekt in vivo [Kot 08]. Röntgen-Bestrahlung führte im Bystander-Gewebe der Milz zu deutlicher epigenetischer Deregulation, und zwar zu einer signifikanten Reduktion der globalen DNA-Methylierung, zur Herunterregulation von Schlüsselproteinen, die die Methylierungsmuster von Histonen und die Packungsdichte von Chromatin regulieren sowie zu einer signifikant erhöhten Expression der microRNAs, die eine wichtige Rolle bei der Stilllegung („silencing“) von Genen bzw. Chromatin spielen. Alle diese Reaktionen führen zu aktivem Chromatin und damit zur Aktivierung von Genen, wie z.B. des Retroposons LINE-1, dessen Aktivierung durch Transposition zur Destabilisierung des Genoms führt, sowie anderer Gene, deren Aktivierung zur strahleninduzierten Karzinogenese beitragen kann.
Koturbash et al. führten mit Hilfe der selektiven Bestrahlung des Kopfes ihres Mausmodells C57/BL den Nachweis, dass sich der Bystander-Effekt in der Milz in männlichen Mäusen von dem in weiblichen Mäusen signifikant unterscheidet [Kot 08a]. Sie analysierten in den Zellen der Milz, die vor der Bestrahlung völlig abgeschirmt war, DNA-Brüche, die globale DNA-Methylierung und zelluläre Parameter wie Apoptose und Zellproliferation, und sie konnten eindeutige geschlechtsspezifische Unterschiede nachweisen. Es fanden sich bei männlichen Mäusen mehr DNA-Brüche und eine Reduzierung der DNA-Methylierung, während in weiblichen Mäusen die Apoptoseraten höher waren als in männlichen Tieren. Diese Unterschiede fielen wesentlich geringer aus, wenn Tiere behandelt wurden, deren Gonaden entfernt wurden. Diese Befunde weisen eindeutig auf eine Rolle der Geschlechtshormone für den Bystander-Effekt bzw. dessen Einfluss auf eine Geschlechtsspezifität der Strahlenempfindlichkeit hin.
Es stellt sich die Frage nach der Natur des Bystander-Signals in vivo sowie nach den molekularen Mechanismen, die zu einer geschlechtsspezifischen Reaktion führen. Eine mögliche Erklärung wäre, dass ein Teil der Blutzellen, die bei der Bestrahlung des Kopfes eine gewisse Strahlendosis erhalten, anschließend in Apoptose oder Nekrose gehen und dann verschiedene lösliche Faktoren wie Cytokine und kleine RNAs abgeben, die als Bystander-Signale dienen könnten [Kot 07]. Allerdings sind mit dieser Hypothese die Befunde von Koturbash et al. nicht vereinbar, die für die vom Bystander-Effekt betroffene Milz eine höhere Apoptoserate bei weiblichen als bei männlichen Mäusen beschreiben, hingegen einen niedrigeren Bystander-Effekt für die Induktion von DNA-Brüchen und die Reduktion an globaler DNA-Methylierung bei weiblichen als bei männlichen Mäusen [Kot 08a, Kot 08b, Kot 08c].
Die Daten der lokalisierten Bestrahlung des Kopfes [Kot 08a, Kot 08b, Kot 08c] sowie frühere Publikationen der Gruppe von Kovalchuk, in denen Tiere nach Ganzkörperbestrahlung analysiert wurden [Kov 04, Pog 04, Rai 04], belegten eindeutig, dass männliche Mäuse empfindlicher gegen Strahlung reagieren und einen stärkeren Bystander-Effekt in der Milz für verschiedene Faktoren, wie z.B. DNA-Brüche und verschiedene epigenetische Parameter, zeigen. Diese Daten veranlassen die Autoren zu der Hypothese, dass männliche Mäuse infolge der indirekten Strahlenwirkung mittels des Bystander-Effektes eine höhere Tumorinzidenz nach Bestrahlung haben sollten als die weiblichen Tiere [Kot 08a]. Dies stünde jedoch in einem Widerspruch zu den epidemiologischen Befunden für den Menschen.
6 Hormonelle Einflüsse
Die in Kapitel 5 dargestellten Befunde der Gruppe von Koturbash et al. [Kot 08a] zeigten mit Hilfe der selektiven Bestrahlung des Kopfes des Mausmodells C57/BL6, dass sich der Bystander-Effekt in der Milz in männlichen Mäusen von dem in weiblichen Mäusen signifikant unterscheidet. Diese Unterschiede fielen wesentlich geringer aus, wenn Tiere behandelt wurden, deren Gonaden nach der Geburt entfernt worden sind, was eindeutig auf eine Rolle der Geschlechtshormone für den Bystander-Effekt bzw. dessen Einfluss auf eine Geschlechtsspezifität der Strahlenempfindlichkeit hinweist. Über mögliche molekulare Mechanismen sind zum jetzigen Zeitpunkt keine Aussagen möglich.
Es stellt sich die Frage nach weiteren Untersuchungen an Tiermodellen und dem Menschen, aus denen Hinweise auf eine hormonell bedingte geschlechtsspezifische Strahlenempfindlichkeit abzuleiten sind. Es ist bekannt, dass zirkulierende Hormone, insbesondere Steroide der Geschlechtsdrüsen und Peptidhormone der Hypophyse, verschiedenste zelluläre Aktivitäten beeinflussen. Daher können Hormone durchaus als mögliche Ursachen für geschlechtsspezifische Unterschiede bei den zellulären Antworten auf ionisierende Strahlung angesehen werden. Allerdings gibt es keine systematischen Studien über den Einfluss des endokrinen Systems bei der Strahlenantwort. Die vorhandene, begrenzte Information bezieht sich auf Brustkrebs und die Rolle von Östrogenen.
Die krebspromovierende Wirkung von Östrogenen wurde durch epidemiologische Studien belegt, welche ein erhöhtes Risiko für Brustkrebs mit erhöhten Östrogenmengen in Verbindung brachten, die zum Beispiel bei einem frühen Einsetzen der Menarche, einer späten Menopause, Hormon-Ersatz-Therapien und Fettleibigkeit nach der Menopause auftreten können [Rus 98]. Hingegen atrophieren die Brustdrüsen in der Abwesenheit von Östrogenen und werden dann resistent gegen karzinogene Agenzien [Rus 98].
Die Induktion von Brustkrebs durch ionisierende Strahlung wurde in Ratten durch Behandlung mit natürlichen oder synthetischen Östrogenen deutlich erhöht [Ina 00]. Zum jetzigen Zeitpunkt ist es jedoch unklar, ob sich beim Menschen ähnliche Reaktionen nachweisen lassen. Eine epidemiologische Studie hat tatsächlich einen Zusammenhang zwischen der Vererbung einer polymorphen Variante des CYP1B1-Gens, das eine Rolle für den Östrogen-Metabolismus spielt, und erhöhter Brustkrebsinzidenz bei amerikanischen Strahlentechnikern nachgewiesen, die niedrigen Strahlendosen ausgesetzt waren [Sig 09].
Es ist noch unklar, wie Östrogene ihre molekulare Funktion bei der Erhöhung des Krebsrisikos ausüben. Es ist vermutet worden, dass es durch die proliferationsstimulierende Wirkung von Östrogenen auf die Epithelzellen der Brustdrüsen zu erhöhter Produktion von reaktivem Sauerstoff und daraus resultierender oxidativer Schädigung kommen könnte. Für Östrogene sind jedoch auch direkte genotoxische Wirkungen nachgewiesen worden [Miz 04, Schn 09]. Paradoxerweise konnte ebenfalls gezeigt werden, dass Östrogene protektive Mechanismen für DNA stimulieren, wie z.B. die Phosphorylierung des DNA-Reparaturproteins BRCA2 [Mal 09]. Dies hatte zur Folge, dass strahleninduzierte Mutagenese reduziert [Puc 99] und p53-abhängige Apoptose erhöht wurde [Dun 08]. Diese Befunde mögen den beobachteten protektiven Effekt von Östrogenen bei bestimmten Typen von Krebs, wie z.B. Basiliomen und Plattenepithel-Karzinomen der Haut, erklären [Man 09].
Literatur
[Bel 05] | Bell, D. W. et al.: Epidermal growth factor receptor mutations and gene amplification in non- |
[Bes 05] | Besplug, J. et al.: Sex and tissue- |
[Bor 09] | Borgmann, K. et al.: Sex- |
[Cas 06] | Cassie, S. et al.: Novel retinoblastoma binding protein RBBP9 modulates sex- |
[Cox 80] | Cox, R.; Masson, W. K.: Radiosensitivity in cultured human fibroblasts. Int J Radiat Biol Relat Stud Phys Chem Med 38(5):575- |
[Dan 07] | Dange, P. et al.: Radiation- |
[Dun 08] | Dunphy, K. A. et al.: Estrogen and progesterone induce persistent increases in p53- |
[Gol 07] | Goldberg, A. D.; Allis, C. D.; Bernstein, E.: Epigenetics: a landscape takes shape. Cell 128(4):635- |
[Huf 91] | Huff, J. et al.: Chemicals associated with site- |
[Ina 00] | Inano, H. et al.: Radiation- |
[Iln 08] | Ilnytskyy, Y. et al.: Altered microRNA expression patterns in irradiated hematopoietic tissues suggest a sex- |
[Iln 09] | Ilnytskyy, Y.; Koturbash, I.; Kovalchuk, O.: Radiation- |
[Jos 04] | Joseph, L. J.; Patwardhan, U. N.; Samuel, A. M.: Frequency of micronuclei in peripheral blood lymphocytes from subjects occupationally exposed to low levels of ionizing radiation. Mutat Res 564(1):83- |
[Kni 06] | Knippers, R.: Molekulare Genetik. Vol. 9. Stuttgart: Thieme Verlag, 2006 |
[Kot 06a] | Koturbash, I. et al.: Irradiation induces DNA damage and modulates epigenetic effectors in distant bystander tissue in vivo. Oncogene 25(31):4267- |
[Kot 06b] | Koturbash, I. et al.: Epigenetic dysregulation underlies radiation- |
[Kot 07] | Koturbash, I. et al.: Role of epigenetic effectors in maintenance of the long- |
[Kot 08a] | Koturbash, I. et al.: Radiation- |
[Kot 08b] | Koturbash, I. et al.: In vivo bystander effect: cranial X- |
[Kot 08c] | Koturbash, I. et al.: Sex- |
[Kov 04] | Kovalchuk, O. et al.: Dissimilar genome response to acute and chronic low- |
[Kov 08a] | Kovalchuk, O. et al.: Involvement of microRNA- |
[Kov 08b] | Kovalchuk, O.: Epigenetic research sheds new light on the nature of interactions between organisms and their environment. Environ Mol Mutagen 49(1):1- |
[Kov 08c] | Kovalchuk, O.; Baulch, J. E.: Epigenetic changes and nontargeted radiation effects – is there a link? Environ Mol Mutagen 49(1):16- |
[Lit 88] | Little, J. B. et al.: Survival of human diploid skin fibroblasts from normal individuals after X- |
[Mac 07] | Mack, G. S.: MicroRNA gets down to business. Nat Biotechnol 25(6):631- |
[Maf 02] | Maffei, F. et al.: Micronuclei frequencies in hospital workers occupationally exposed to low levels of ionizing radiation: influence of smoking status and other factors. Mutagenesis 17(5):405- |
[Maf 04] | Maffei, F. et al.: Spectrum of chromosomal aberrations in peripheral lymphocytes of hospital workers occupationally exposed to low doses of ionizing radiation. Mutat Res 547(1- |
[Mal 09] | Malone, J. L. et al.: Oestrogen- |
[Man 09] | Mancuso, M.; Gallo, D.; Leonardi, S. et al.: Modulation of basal and squamous cell carcinoma by endogenous estrogen in mouse models of skin cancer. Carcinogenesis 30(4):721, 2009 |
[Mar 03] | Marcon, F. et al.: Assessment of individual sensitivity to ionizing radiation and DNA repair efficiency in a healthy population. Mutat Res 541(1- |
[May 91] | Mayer, P. J. et al.: Gender differences in age- |
[Mea 08] | Meadows, S. K. et al.: Gene expression signatures of radiation response are specific, durable and accurate in mice and humans. PLoS ONE 3(4):e1912, 2008 |
[Miz 04] | Mizutani, A. et al.: Extensive chromosomal breaks are induced by tamoxifen and estrogen in DNA repair- |
[Mue 78] | Mueller, W. A.: Late effects after incorporation of the short- |
[Mul 01] | Muller, W. U. et al.: Radiation sensitivity of lymphocytes from healthy individuals and cancer patients as measured by the comet assay. Radiat Environ Biophys 40(1):83- |
[O'Bri 93] | O'Brien, S. N.; Larcom, L. L.; Baxley, E. G.: Correlates of plasma cortisol and DNA repair in human peripheral lymphocytes: suppression of repair in women taking estrogen. Horm Res 39(5- |
[Pao 04] | Pao, W. et al.: EGF receptor gene mutations are common in lung cancers from "never smokers" and are associated with sensitivity of tumors to gefitinib and erlotinib. Proc Natl Acad Sci USA 101(36): 13306- |
[Pau 07] | Pauler, F. M.; Koerner, M. V.; Barlow, D. P.: Silencing by imprinted noncoding RNAs: is transcription the answer? Trends Genet 23(6):284- |
[Pog 04] | Pogribny, I. et al.: Dose- |
[Puc 99] | Puck, T. T.; Johnson, R.; Webb, P.: Mutation inhibition by beta- |
[Rai 04] | Raiche, J. et al.: Sex- and tissue- |
[Ric 91] | Ricoul, M.; Dutrillaux, B.: Variations of chromosome radiation sensitivity in fetal and adult mice during gestation. Mutat Res 250(1- |
[Ric 97] | Ricoul, M.; Sabatier, L.; Dutrillaux, B.: Increased chromosome radiosensitivity during pregnancy. Mutat Res 374(1): 73- |
[Rie 08] | Ries, L. A. G. et al.: SEER Cancer Statistics Review, 1975- |
[Rod 07] | Rodemann, H. P.; Dittmann, K.; Toulany, M.: Radiation- |
[Ros 05] | Ross, M. T. et al.: The DNA sequence of the human X chromosome. Nature 434(7031):325- |
[Rus 98] | Russo, I. H.; Russo, J.: Role of hormones in mammary cancer initiation and progression. J Mammary Gland Biol Neoplasia 3(1):49- |
[Schm 03] | Schmitz, A. et al.: Intrinsic susceptibility to radiation- |
[Schn 09] | Schnyder, S. et al.: Estrogen treatment induces MLL aberrations in human lymphoblastoid cells. Leuk Res, 2009. |
[Sig 09] | Sigurdson, A. J. et al.: Polymorphisms in estrogen biosynthesis and metabolism- |
[Sil 04] | Silasi, G. et al.: Selective brain responses to acute and chronic low- |
[Ska 03] | Skaletsky, H. et al.: The male- |
[Sor 00] | Sorensen, K. J. et al.: The in vivo dose rate effect of chronic gamma radiation in mice: translocation and micronucleus analyses. Mutat Res 457(1- |
[SSK 08] | Strahlenschutzkommission (SSK): Einfluss der natürlichen Strahlenexposition auf die Krebsentstehung in Deutschland. Veröffentlichungen der Strahlenschutzkommission, Band 62. Stellungnahme der Strahlenschutz- |
[Tam 08a] | Tamminga, J. et al.: Paternal cranial irradiation induces distant bystander DNA damage in the germline and leads to epigenetic alterations in the offspring. Cell Cycle 7(9):1238- |
[Tam 08b] | Tamminga, J. et al.: DNA damage- |
[Tan 08] | Tang, G.: MicroRNAs: an exciting and open field calls for extensive study from initial and established investigators. Preface. Biochim Biophys Acta 1779(11):653- |
[Thi 00] | Thierens, H. et al.: Cytogenetic monitoring of hospital workers occupationally exposed to ionizing radiation using the micronucleus centromere assay. Mutagenesis 15(3):245- |
[Tho 07] | Thomas- |
[Wan 00] | Wang, L. E. et al.: Gender difference in smoking effect on chromosome sensitivity to gamma radiation in a healthy population. Radiat Res 154(1):20- |
[Whi 03] | Whitney, A. R. et al.: Individuality and variation in gene expression patterns in human blood. Proc Natl Acad Sci USA 100(4):1896- |
3 Chromatin, d.h. der Komplex aus DNA, die um Histone gewickelt ist, und weiteren Proteinen, kommt in zwei Typen vor: relativ wenig kondensiertes Euchromatin, das die Transkription der darin enthaltenen Gene erlaubt, und stark kondensiertes Heterochromatin, das genetisch inaktiv ist. Die Kondensation des Chromatins wird v.a. durch epigenetische Prozesse gesteuert.
4 Vorläufer der Geschlechtschromosomen war ein normales Chromosomenpaar (d.h. Autosomenpaar). Nachdem ein Partner eine geschlechtsdeterminierende Sequenz entwickelt hatte und meiotische Rekombination zwischen den Partnern aufgrund von Inversionen verhindert wurde, entwickelten sich beide Chromosomen auseinander.
5 Die Autoren selbst nennen die beobachteten Effekten in Organen, die nicht bestrahlt wurden, Bystander-Effekte. Ähnliche Effekte wurden früher als abskopale Effekte benannt, während der Begriff Bystander-Effekte vor allem für Effekte in nicht-bestrahlten Zellen in Zellkultur oder dreidimensionalen Zellkultursystemen benutzt wurde.
