Bekanntmachung einer Empfehlung der Strahlenschutzkommission (Evaluierung von Nutzen und Risiken im qualitätsgesicherten Mammographie-Screening in Deutschland)
Zurück zur Teilliste Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit
| Strahlenschutzkommission Geschäftsstelle der |
Evaluierung von Nutzen und Risiken im
qualitätsgesicherten Mammographie-Screening
in Deutschland
Empfehlung der Strahlenschutzkommission
Verabschiedet in der 231. Sitzung der Strahlenschutzkommission am 9./10. Dezember 2008
Die Einführung eines bevölkerungsbasierten, qualitätsgesicherten Mammographie-Screenings in Deutschland zielt auf eine Reduktion der Brustkrebsmortalität unter den anspruchsberechtigten Frauen. Die Anwendung der Mammographie, einer auf Röntgenstrahlung beruhenden Methode, unterliegt den Grundsätzen des Strahlenschutzes. Die mit der Mammographie verbundene Exposition mit ionisierender Strahlung könnte zu einer geringen Erhöhung des Brustkrebsrisikos unter den untersuchten Frauen führen. In einer früheren Stellungnahme kam die Strahlenschutzkommission (SSK) aufgrund der bestehenden Datenlage, die von einer deutlichen Reduktion der Mortalität infolge des Screenings ausging, zu dem Schluss, dass die Strahlenexposition für 50- bis 69-jährige Frauen kein Argument gegen ein qualitätsgesichertes Mammographie-Screening innerhalb eines Krebsfrüherkennungsprogramms ist. Da beim Mammographie-Screening viele gesunde Frauen untersucht werden, um bei einigen wenigen vorhandene Tumoren früher zu erkennen, ist eine Abwägung von Nutzen und Risiko des Mammographie-Screenings nötig. Die SSK hatte es in ihrer damaligen Stellungnahme für erforderlich gehalten, die weiteren Entwicklungen zu verfolgen. Hinsichtlich des angenommenen Strahlenrisikos haben sich auf Grund der Erkenntnisse der letzten Jahre keine Änderungen ergeben. Nunmehr sollte, nach Einführung des bevölkerungsbasierten, qualitätsgesicherten Mammographie-Screening-Programms in Deutschland, speziell für dieses Programm der Nutzen quantitativ bewertet werden, da die Effektivität von Screening-Programmen von der Programmgestaltung abhängt. Zudem werden die Brustkrebsinzidenz und -mortalität von verschiedenen Faktoren beeinflusst, die im zeitlichen Verlauf sowie regional variieren können.
Die SSK wurde beauftragt, geeignete Rahmenbedingungen für eine Evaluierung von Nutzen und Risiken des qualitätsgesicherten Mammographie-Screenings in Deutschland zu empfehlen. Diese Evaluierung soll vor allem, aber nicht ausschließlich, prüfen, ob das geforderte Ziel einer Reduktion der Brustkrebsmortalität in der anspruchsberechtigten Bevölkerung erreicht wird. Zudem sollen auch andere Endpunkte, z.B. Lebensqualität, Fehldiagnosen, oder Überdiagnosen berücksichtigt werden, um eine Minimierung der Belastungen, die mit einem Mammographie-Screening verbunden sein können, zu gewährleisten.
Die Evaluierung der Wirksamkeit des Screenings in Hinblick auf Mortalität und Verhältnis von Nutzen und Risiken erfordert die Anwendung komplexer epidemiologischer und statistischer Methoden. Dies ist nach Auffassung der SSK eine eigenständige Aufgabe, die über die Anforderungen der Prozessevaluierung, wie sie in der Früherkennungsrichtlinie (Änderung der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Früherkennung von Krebserkrankungen (vom 15.12.2003) B 4 Buchstabe n) festgelegt sind, hinausgeht.
Bisherige Evaluierungen der Wirksamkeit von bevölkerungsbasierten Mammographie-Screening-Programmen in anderen Ländern bedienten sich einer Reihe unterschiedlicher epidemiologischer Studien (Trendanalysen, Fall-Kontroll-Studien, Kohortenstudien). Mehrere Faktoren, die zu einer Verzerrung und Fehlinterpretation der Ergebnisse führen können, wurden identifiziert (z.B. lead-time bias, length-time bias, Überdiagnosen, self-selection bias, unterschiedliche Brustkrebs-Inzidenz und -Mortalität in Vergleichregionen vor Einführung des Screenings, zeitliche Veränderungen in Brustkrebsinzidenz und -mortalität, die vom Screening unabhängig sind, etc.). Diese Faktoren erfordern die Entwicklung von Methoden zu ihrer adäquaten Berücksichtigung; dabei ist zu erwarten, dass die speziellen Eigenheiten des deutschen Screening-Programms (z.B. rasche, nicht randomisierte Einführung mit verzögerter Flächenabdeckung, Datenschutzvorschriften) erschwerend wirken.
Um eine nachhaltige Evaluierung von Nutzen und Risiken des qualitätsgesicherten deutschen Mammographie-Screening-Programms zu erlauben, empfiehlt die SSK:
- 1.
- Die Evaluierung der Wirksamkeit des deutschen qualitätsgesicherten Mammographie-Screenings muss durch ausgewiesene Fachwissenschaftler1 erfolgen. Entsprechende Evaluierungsprojekte müssen in transparenter Weise vergeben werden. Die Evaluierung ist unabhängig von den am Screening-Programm Beteiligten durchzuführen.
- 2.
- Um die Nachhaltigkeit des langfristig angelegten Evaluierungsprozesses sicher zu stellen, wird vorgeschlagen, eine unabhängige Stelle zur wissenschaftlichen Koordination zu schaffen. Die Tätigkeit dieser Stelle soll durch einen wissenschaftlichen Beirat begleitet werden, der gegebenenfalls unter Hinzuziehen ausländischer Experten besetzt wird.
- 3.
- Eine wesentliche Voraussetzung für erfolgreiche Evaluierungsstrategien ist die Existenz von epidemiologischen Krebregistern, so dass diese dort, wo das noch nicht geschehen ist, möglichst schnell eingerichtet werden müssen.
- 4.
- Es ist sicher zu stellen, dass die wissenschaftliche (externe) Evaluierung in Zusammenarbeit mit den epidemiologischen Krebsregistern erfolgen kann. In allen Bundesländern müssen vergleichbare rechtliche Grundlagen für den Datenabgleich zwischen Krebsregistern und Screening-Programm sowie vergleichbare Regelungen zur Umsetzung der Früherkennungsrichtlinie getroffen werden, um aussagekräftige Evaluierungen zu ermöglichen. Nach Ansicht der SSK ist dabei ist klar zu stellen, dass für eine sinnvolle Nutzung der Daten im Rahmen einer Mortalitätsevaluierung ein regelmäßiger Abgleich der in den Krebsregistern erfassten Brustkrebsfälle mit den Daten aller Frauen, die jemals am Screening teilgenommen haben, sowie deren vollständigen Screening-Historien nötig ist.
- 5.
- Die SSK hält es, angesichts der äußerst komplizierten Situation in Deutschland, für sinnvoll, mehrere komplementäre Studien zur Mortalitätsevaluierung durchzuführen, um abschließend belastbare Aussagen zur Wirksamkeit des Screening-Programms zu erzielen. Im Rahmen begrenzter Studien sollen zudem weitere Endpunkte untersucht werden, die Aussagen zum Einfluss des Screening-Programms auf Lebensqualität, Therapieentscheidung, Umfang von nicht im Rahmen des Screenings durchgeführten Mammographieuntersuchungen etc. zulassen. Die SSK empfiehlt, die Eckpunkte geeigneter Evaluierungsvorhaben von einem Expertengremium, z.B. dem oben genannten wissenschaftlichen Beirat, konkretisieren zu lassen.
- 6.
- Für wissenschaftliche Zwecke zur Evaluierung von Nutzen und Risiken des Screening-Programms müssen sämtliche Daten, auch diejenigen, die aus Prozess-Evaluierungsprozessen hervor gehen, anonymisiert zugänglich gemacht werden. Die SSK empfiehlt, bei der Prozessevaluierung zusätzlich zu den Vorgaben der Früherkennungsrichtlinie nicht nur die relativen Anteile der einzelnen Tumorstadiengruppen zu bestimmen, sondern deren Häufigkeit bezogen auf die Bevölkerung. Zusätzlich empfiehlt sie, auch die Stadienverteilung von Intervallkarzinomen zu bestimmen.
Es besteht die Gefahr, dass in der gegenwärtig entscheidenden Einführungsphase wichtige Daten unwiederbringlich verloren gehen. Es ist daher eine zügige Umsetzung der Empfehlung anzustreben.
Evaluierung von Nutzen und Risiken im
qualitätsgesicherten Mammographie-Screening
in Deutschland
Wissenschaftliche Begründung
zur Empfehlung der Strahlenschutzkommission
Verabschiedet in der 231. Sitzung der Strahlenschutzkommission am 9./10. Dezember 2008
Inhaltsverzeichnis
1 | Einführung | 3 | |
2 | Brustkrebsinzidenz und Mortalität | 5 | |
3 | Neue Erkenntnisse zur Strahlenempfindlichkeit der weiblichen Brust und ihr Einfluss auf die Risikoschätzung | 9 | |
3.1 | Meta- | 9 | |
3.2 | Analyse der Inzidenzdaten der LSS- | 11 | |
3.3 | BEIR VII (2006) | 11 | |
3.4 | Aktuelle Analyse der Inzidenzdaten der LSS- | 11 | |
3.5 | Risikoabschätzung für Frauen, die an einem Mammographie- | 11 | |
4 | Erkenntnisse zum Einfluss technologischer Veränderungen auf die Risikoschätzungen | 12 | |
5 | Grundlagen einer Evaluierung von Screening- | 13 | |
5.1 | Surrogat- | 14 | |
5.2 | Mortalitätsevaluierung | 15 | |
5.3 | Mögliche weitere Endpunkte für die Evaluierung der Wirksamkeit | 18 | |
6 | Spezielle Situation des qualitätsgesicherten Mammographie- | 19 | |
7 | Richtlinien zur Evaluierung im deutschen Mammographie- | 21 | |
8 | Möglichkeiten für eine Gesamtevaluierung von Nutzen und Risiken unter den deutschen Bedingungen | 24 | |
Literatur | 26 | ||
- 1.
- Einführung
Mit dem Bundestagsbeschluss vom 28. Juni 2002 wurde die Einführung eines qualitätsgesicherten, bundesweiten und bevölkerungsbezogenen Mammographie-Screening-Programms für Frauen zwischen 50 und 69 Jahren in Deutschland beschlossen. Dabei soll die auf Röntgenstrahlung basierende Mammographie im zweijährigen Intervall durchgeführt werden. Die zur Einführung nötigen Änderungen der Krebsfrüherkennungs-Richtlinien [1] und des Bundesmantelvertrags Ärzte/Ersatzkassen [2] traten am 1. Januar 2004 in Kraft. Nachdem seit 2005 begonnen wurde, Screening-Einheiten aufzubauen, wurde eine flächendeckende Implementierung des Screening-Programms bis zum Ende des dritten Quartals 2008 angestrebt [3].
Wie alle Maßnahmen zur Früherkennung von Krebserkrankungen zielt das Brustkrebs-Screening primär auf eine Reduktion der Krebsmortalität durch Vorverlegung der Diagnose auf ein prognostisch günstigeres Tumorstadium, verbunden mit besseren Therapiemöglichkeiten. Die Durchführung von Reihenuntersuchungen in einer asymptomatischen Bevölkerung ist jedoch mit einer Reihe von Problemen behaftet, die eine detaillierte Bewertung von Nutzen und assoziierten Risiken nötig macht [4]. Die Anwendung der Mammographie, einer auf Röntgenstrahlung beruhenden Methode, für die Brustkrebs-Früherkennung wirft neben den für alle Screening-Programme geltenden Fragen zusätzlich die Frage auf, inwieweit die hiermit verbundene Exposition mit ionisierender Strahlung unter den untersuchten Frauen das Brustkrebsrisiko erhöhen kann.
Nach § 23 Abs. 1 Röntgenverordnung (RöV) bedarf jede Anwendung von Röntgenstrahlung am Menschen in Ausübung der Heilkunde einer rechtfertigenden Indikation, bei der festgestellt wird, dass der zu erwartende gesundheitliche Nutzen der Untersuchung das damit verbundene Strahlenrisiko überwiegt. Röntgenreihenuntersuchungen zur Brustkrebs-Früherkennung stellen nach dem Verständnis der RöV eine Anwendung außerhalb der Heilkunde im engeren Sinne dar, da sie nicht eine Patientin mit einem abklärungsbedürftigen Befund betreffen. Solche Untersuchungen müssen nach § 25 Abs. 1 Satz 2 RöV gesondert zugelassen werden, um sicherzustellen, dass insbesondere der Strahlenschutz in angemessener Weise berücksichtigt wird. Die besondere rechtliche Zulassung ersetzt die sonst bei Röntgenuntersuchungen erforderliche Rechtfertigung im Einzelfall. Zuständig für solche Zulassungen sind die obersten Landesgesundheitsbehörden, die diese auf der Grundlage der Röntgenverordnung für das jeweilige Bundesland aussprechen. Die erforderlichen organisatorischen und rechtlichen Rahmenbedingungen im Bereich des Sozialrechtes sind zum 1. Januar 2004 in Kraft getreten.
Im Vorfeld der Einführung des qualitätsgesicherten, bundesweiten Mammographie-Screenings hat die Strahlenschutzkommission (SSK) zum Mammographie-Screening eine Stellungnahme vorgelegt, die insbesondere das mit dem Screening verbundene Strahlenrisiko bewertet [5]. Sie kam zu dem Schluss, „dass die Strahlenexposition für 50- bis 69-jährige Frauen kein Argument gegen ein qualitätsgesichertes Mammographie-Screening innerhalb eines Krebsfrüherkennungsprogramms ist, wenn von einem Nutzen eines solchen Programms auszugehen ist.“ Zum damaligen Zeitpunkt waren vor allem Ergebnisse von randomisierten Studien verfügbar, die auf eine Senkung der Brustkrebsmortalität um 10 - 30 % unter den teilnehmenden Frauen hindeuteten [5]. Daneben gab es erste Ergebnisse der Evaluierung von regionalen oder nationalen Screening-Programmen aus verschiedenen Ländern [5].
Der aufgrund der Erfahrungen dieser Länder zu erwartende Nutzen eines Mammographie-Screenings in Hinblick auf die Mortalitätsreduktion überwog nach Einschätzung der SSK das mit der Strahlenexposition verbundene Risiko. Voraussetzung für die Bewertung der SSK war, dass das Mammographie-Screening im Rahmen eines bevölkerungsbezogenen Programms durchgeführt wird, das den hohen Qualitätsanforderungen der European Guidelines for Quality Assurance in Breast Cancer Screening and Diagnosis [6] entspricht und dass positive Effekte durch das qualitätsgesicherte Screening-Programm in Hinblick auf die Reduktion falschpositiver Befunde und die Vermeidung unnötiger Abklärungsdiagnostik und Therapiemaßnahmen eintreten.
Da Brustkrebsinzidenz und -mortalität von verschiedenen Faktoren beeinflusst werden, die abhängig vom zugrunde liegenden Gesundheitssystem im zeitlichen Verlauf sowie geographisch variieren können, und da die Effektivität von Screening-Programmen von den Faktoren der Programmgestaltung abhängen kann, ist es nötig, die Wirksamkeit des deutschen Screening-Programms nach seiner Einführung umfassend zu evaluieren. Dazu gehört eine Evaluierung der Prozessindikatoren, die vor allem von der Kooperationsgemeinschaft Mammographie geleistet werden soll [1, 2]. Diese soll entsprechend den detaillierten Vorgaben der Europäischen Leitlinien [6] erfolgen. Daneben ist eine Evaluierung der Wirksamkeit des Programms nötig, die vor allem aber nicht ausschließlich, prüfen soll, ob das geforderte Ziel einer Reduktion der Brustkrebsmortalität in der anspruchsberechtigten Bevölkerung erreicht wird.
Im Gegensatz zu den Prozessindikatoren ist das Vorgehen für die Evaluierung der Wirksamkeit nicht detailliert in den Europäischen Leitlinien festgelegt. Dies lässt sich zum einen dadurch erklären, dass wichtige Grundvoraussetzungen, wie beispielsweise eine flächendeckende Krebsregistrierung, nicht überall in Europa (und auch noch nicht in Deutschland) realisiert sind. Weiter hängt die Anwendung adäquater epidemiologischer Methoden für die Evaluierung stark von den genauen Bedingungen der Programmein‑ und ‑durchführung in den einzelnen Ländern ab. Evaluierungskonzepte sind daher jeweils an die Gegebenheiten vor Ort anzupassen, um aussagekräftige epidemiologische Methoden zu entwickeln. Zudem werden Effekte auf die Brustkrebs-Mortalität in der Bevölkerung frühestens 5 bis 10 Jahre nach Programmeinführung erkennbar. Die geforderte Gesamtevaluierung des deutschen Screening-Programms kann demnach nur durch eine langfristig angelegte Zusammenarbeit von Experten der Epidemiologie und verwandter Fachgebiete geleistet werden.
Aufgrund der Verwendung ionisierender Strahlung im Mammographie-Screening und ihrer nötigen Rechtfertigung wurde die SSK vom Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit beauftragt, die Rahmenbedingungen für Erfolg versprechende Gesamtevaluierungsstrategien vorzulegen. In der vorliegenden Empfehlung werden dazu zuerst die Ausgangssituation hinsichtlich Brustkrebsinzidenz und -mortalität in Deutschland und neuerer Erkenntnisse zum strahlenbedingten Risiko von Mammographieuntersuchungen vorgestellt. Dann wird ein Überblick über Maßnahmen zur Evaluierung von Mammographie-Screening-Programmen in anderen Ländern gegeben, bevor auf die spezifischen Bedingungen in Deutschland eingegangen wird.
- 2.
- Brustkrebsinzidenz und Mortalität
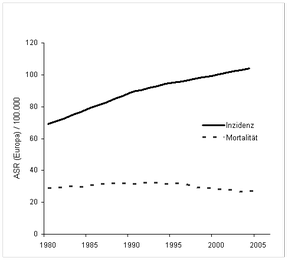
In Deutschland erkranken jährlich über 57 700 Frauen an Brustkrebs [7] und etwa 17 300 sterben jedes Jahr daran [8]. Die altersstandardisierte Brustkrebs-Inzidenz stieg in Deutschland, wie in allen industrialisierten Ländern, in den letzten Jahrzehnten kontinuierlich an, nämlich von 70/100 000 im Jahr 1980 auf 105/100 000 im Jahr 2004 [7] (s. Abb. 1).
|
|
- Abb. 1:
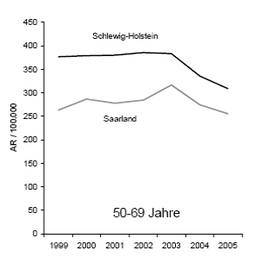
- Links: Altersstandardisierte Inzidenzraten (durchgezogenen Linie) und Mortalitätsraten (durchbrochene Linie) für Brustkrebs in Deutschland 1980 bis 2004 (Fälle pro 100 000 pro Jahr; Bezug: Europastandardpopulation; aus [7])Rechts: Brustkrebsinzidenz der Altersgruppe 50 ‑ 69 Jahre im Saarland und Schleswig-Holstein von 1999-2005 (AR = altersspezifische Rate; nach [9])
Als Ursachen werden neben Veränderungen in Zahl der Kinder und Alter bei Geburt des ersten Kindes, verändertem Lebensstil und Gebrauch von Hormonersatztherapie (Östrogen/ Gestagen-Kombinationstherapie) auch die verbesserte Diagnostik und zunehmende Nutzung der Mammographie angesehen. Etwa seit dem Jahr 2003 deutet sich eine Trendumkehr in der alterstandardisierten Brustkrebsinzidenz an (Abb. 1), die mit einem Rückgang der Verwendung von Hormonersatztherapie einher geht [9 ‑ 11]. Eine ähnliche Trendumkehr ist in verschiedenen Ländern zu erkennen und wurde besonders gut in den Vereinigten Staaten von Amerika untersucht, wo die abnehmende Nutzung der Hormonersatztherapie als Hauptursache angesehen wird, wenn auch weitere mögliche Ursachen diskutiert werden [12 ‑ 16].
Trotz der deutlichen Zunahme der altersstandardisierten Inzidenz ist die altersstandardisierte Brustkrebsmortalität in den letzten Jahrzehnten in Deutschland weitgehend stabil geblieben, und seit Mitte der 1990er Jahre ist sogar eine Abnahme zu beobachten (Abb. 1; [17]). Von 1996/1997 bis 2005/2006 sank die altersstandardisierte Brustkrebsmortalität in Deutschland um etwa 15 % (von 31,0 auf 25,9, jeweils pro 100 000), wobei die relative Reduktion von der Altersgruppe abhängt (siehe Abb. 2). Auffällig ist der starke relative Rückgang um etwa 35 % in den jüngeren Altersklassen bis 50 Jahre. Welche Anteile an diesem Rückgang eine verbesserte Therapie des prämenopausalen Mammakarzinoms und eine verbesserte Früherkennung haben, ist bislang unklar.
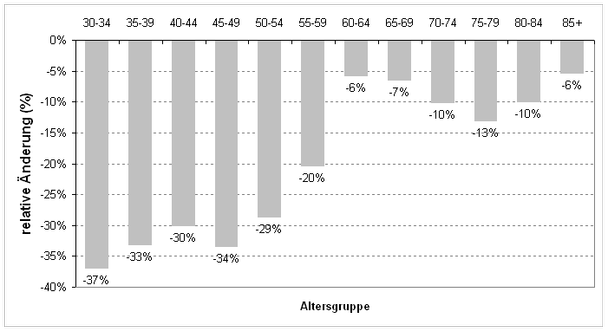
- Abb. 2:
- Relative Reduktion der Brustkrebsmortalität in Deutschland 2005/2006 vs. 1996/1997 in verschiedenen Altersklassen. Datenquelle: [8] und [17].
Eine Abnahme der Brustkrebsmortalität wird auch in anderen Ländern beobachtet [18, 19], auch in Ländern, die derzeit kein flächendeckendes Screening-Programm unterhalten [20]. Als Erklärungen können verbesserte Therapien und Früherkennungsmaßnahmen (außerhalb eines organisierten Screening-Programms) herangezogen werden (z.B. [21]).
Für die Mortalitätsevaluierung im Rahmen des deutschen Programms sind die großen Unterschiede von Inzidenz und Mortalität für Brustkrebs zwischen den Bundesländern von Bedeutung. Es zeichnet sich hier ein geographisches Muster für Deutschland ab (s. Abb. 3 exemplarisch für die Altersgruppe der 50- bis 69-Jährigen). Niedrigste Werte finden sich in Ostdeutschland, höchste in Norddeutschland, der Süden und Westen liegen bei beiden Indikatoren im Mittelfeld.
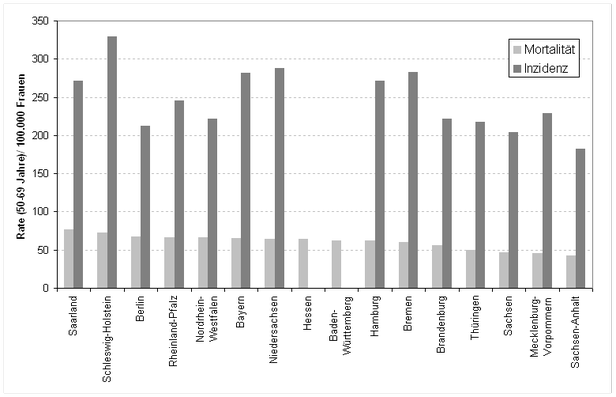
- Abb. 3:
- Brustkrebsmortalität und -inzidenz in der Altersklasse der 50- bis 69-jährigen Frauen im Jahr 2004. Datenquelle: [8] und Angaben der Gesellschaft der epidemiologischen Krebsregister in Deutschland, 2008.
Eine zentrale Frage bei der Bewertung der Wirksamkeit des bundesweiten Mammographie-Screenings ist, den jetzt schon zu beobachtenden Trend zur Mortalitätsreduktion von einer weiteren, screeningbedingten Mortalitätsreduktion abzugrenzen. Insbesondere ist zu berücksichtigen, dass in Deutschland lange Zeit ein ausgedehntes so genanntes graues Mammographie-Screening2 stattgefunden hat und immer noch stattfindet. Aufgrund dieser Situation wurden bereits vor Einführung des Mammographie-Screening-Programms in Deutschland Tumoren durch Mammographie entdeckt, was Einfluss auf die Brustkrebsmortalität hatte bzw. hat.
Nach Auswertungen der deutschen epidemiologischen Krebsregister (GEKID, vormals ABKD) wiesen im Zeitraum 1997 bis 1999 etwas mehr als 50 % der Brustkrebspatientinnen ein günstiges Tumorstadium (T-Kategorie) „T1 oder in situ“ (nicht invasiver Brustkrebs oder Tumor < 2 cm ) auf [22]. Dieses Niveau entspricht etwa dem in den Niederlanden zu Beginn des Mammographie-Screening-Programms (1990). Im Verlauf des Screening-Programms stieg dort der Anteil an Patientinnen mit günstigerem Stadium auf knapp 65 % an. Damit liegt der Anteil von Patientinnen mit günstigeren Tumorstadien im Zeitraum 1997 bis 1999 in Deutschland um etwa 10 % niedriger als in den Niederlanden im Jahre 1996. Auch die Ergebnisse aus Großbritannien (Region West Midlands) zeigen unter laufendem Screening in den Jahren 1997 bis 1999 eine günstigere T-Stadienverteilung, mit über 60 % der Tumoren in Stadium T1 oder in situ [22].
Die günstigere Tumorstadienverteilung in den Screening-Ländern deutet auf das Potential eines qualitätsgesicherten Screening-Programms hin. Man erwartet, dass eine günstigere Tumorstadienverteilung langfristig auch zu einer Mortalitätsreduktion führt, obwohl die Tumorstadienverteilung selbst nur als Surrogat (Ersatz)-Parameter für die Wirksamkeit des Screenings angesehen werden kann.
Insgesamt liegt das Mortalitätsniveau in Deutschland im EU-Vergleich im oberen Drittel ([23], s. Abb. 4). Obwohl beispielsweise in den Niederlanden und Großbritannien schon seit längerem bevölkerungsbezogene Mammographie-Screening-Programme eingeführt sind, liegt das Mortalitätsniveau in diesen Ländern über dem Deutschlands. Dies zeigt, dass viele Faktoren für das erreichbare Mortalitätsniveau verantwortlich sind.
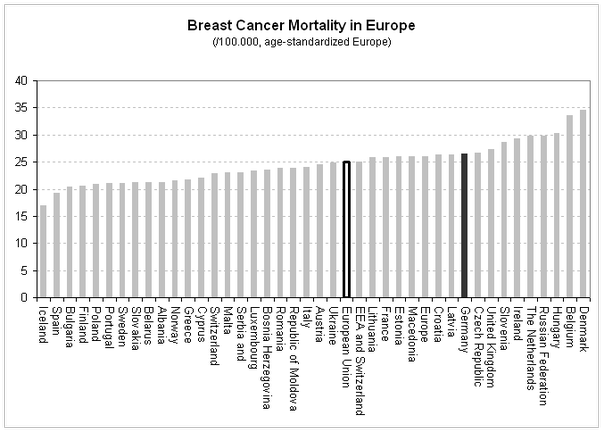
- Abb. 4:
- Schätzungen zur Brustkrebsmortalität in Europa [23]
- 3.
- Neue Erkenntnisse zur Strahlenempfindlichkeit der weiblichen Brust und ihr Einfluss auf die Risikoschätzung
Die Bewertung des mit einem Mammographie-Screening-Programm verbundenen strahlenbedingten Risikos stützt sich auf eine solide Basis epidemiologischer Daten, die von den Beobachtungen an japanischen Frauen, die die Atombombenangriffe überlebten [24 ‑ 28], bis zu den Erfahrungen aus diagnostischen und therapeutischen Anwendung ionisierender Strahlung, insbesondere Röntgenstrahlung, reichen [24, 26, 29, 30].
Seit der im Jahre 2002 veröffentlichten Stellungnahme der Strahlenschutzkommission „Mammographie-Screening in Deutschland: Bewertung des Strahlenrisikos“ [5] erschienen drei Veröffentlichungen zur Inzidenz des strahleninduzierten Mammakarzinoms:
- •
- eine Meta-Analyse von Preston et al. im Jahre 2002 [26],
- •
- eine Publikation zu den Brustkrebs-Inzidenzdaten der Life Span Study (LSS)-Kohorte der japanischen Atombombenüberlebenden von Land et al. im Jahre 2003 [27] und
- •
- der neueste Bericht von Preston et al. zur Krebsinzidenz bei den Atombombenüberlebenden (Follow-up 1958 bis 1998) [28].
Darüber hinaus wurde im Jahre 2003 der neueste Bericht zur Krebsmortalität bei den Atombombenüberlebenden (Follow-up 1950 bis 1997) veröffentlicht, der auch Schätzungen des Brustkrebs-Mortalitätsrisikos enthält [25]. Jedoch besitzen die Brustkrebs-Inzidenzdaten für die Kohorte der Atombombenüberlebenden eine höhere Aussagekraft, da sie – insbesondere wegen der höheren Fallzahlen, speziell für höhere Altersgruppen bei Strahlenexposition – mit weniger Unsicherheiten behaftet sind als die Mortalitätsdaten. Daher wird im Folgenden auf die aktuellsten Studien zur Brustkrebsinzidenz eingegangen.
Des Weiteren wurde im Jahre 2006 der neue Bericht des BEIR-Kommittees (BEIR: Biological Effects of Ionising Radiation) publiziert (BEIR VII Report [30]). Sowohl für Brustkrebsinzidenz als auch für Brustkrebsmortalität werden vom BEIR VII-Komitee Risikomodelle angegeben.
- 3.1
- Meta-Analyse von Preston et al. (2002)
Preston et al. [26] beziehen in ihre Meta-Analyse die Daten von acht Studien ein, in denen die Brustkrebsinzidenz nach Strahlenexposition untersucht wurde. In die Meta-Analyse gehen die Daten von insgesamt rund 77 500 Frauen (1500 Brustkrebsfälle) ein. Dabei tragen die Daten der Atombombenüberlebenden wesentlich zum Gesamtdatensatz bei (insgesamt 707 Brustkrebsfälle bei 47 726 Atombombenüberlebenden; Follow-up 1958 bis 1993).
Die Autoren führten zunächst für jede der Studienkohorten eine separate Risikomodellierung durch, bevor sie die Daten aller oder ausgewählter Kollektive zusammenfassten und einer gemeinsamen Risikoanalyse zuführten. Die Risikomodellierung lieferte zum Teil erhebliche Unterschiede für die einzelnen Studienkohorten. Ein gemeinsames Risikomodell ("simple pooled model") für den zusammengefassten Datensatz lieferte eine nur unzureichende Güte der Anpassung.
Neben den Daten der Atombombenüberlebenden gehen in die Metaanalyse von Preston et al. Daten von Frauen ein, die aus medizinisch-diagnostischen oder medizinisch-therapeutischen Gründen strahlenexponiert wurden. Entsprechend unterscheiden sich die Kollektive bezüglich Strahlenart und Strahlungsmodalität. Darüber hinaus unterscheiden sich die Studienkollektive bezüglich der Beobachtungszeiten, Alter bei Exposition und ihrer Normalraten für Brustkrebs, wobei die Brustkrebsnormalraten für die japanische Population erheblich geringer sind als die für die westlichen Kohorten.
Ein Vergleich und eine gemeinsame Analyse der von Preston et al. betrachteten Studienkollektive ist also von zahlreichen komplexen Faktoren beeinflusst und somit schwierig. Die Autoren kommen zu dem Schluss, dass kein einfaches Risikomodell existiert, das die Daten aller Studienkohorten hinreichend anpasst. Die von den Autoren favorisierten Risikomodelle sind entsprechend komplex.
In der Publikation von Preston et al. wird auch die für strahleninduzierten Brustkrebs wichtige Frage nach dem „Risikotransfer“ zwischen der bestrahlten Bevölkerung und der Zielpopulation, für die das Strahlenrisiko abgeschätzt werden soll, aufgeworfen. Dabei geht es um die Frage, ob für die Abschätzung von Strahlenrisiken das zusätzliche relative Risiko („multiplikatives Transfermodell“) oder das zusätzliche absolute Risiko („additives Transfermodell“) geeigneter ist. Beim relativen Risikomodell wird von der Annahme ausgegangen, dass das zusätzliche (strahlenbedingte) Risiko proportional zum Normalrisiko ist. Wird also das relative Risiko einer bestrahlten Population („Studienpopulation“) auf eine andere Population („Zielpopulation“) übertragen, so geht in die Abschätzung des zusätzlichen Risikos die Normalrate der Zielpopulation ein. Bei Anwendung des absoluten Risikomodells wird dagegen das zusätzliche absolute Risiko direkt auf die Zielpopulation übertragen. Die Wahl des Transfermodells ist dann problematisch, wenn sich die Normalraten der bestrahlten Studienbevölkerung stark von denen der Zielpopulation unterscheiden, wie dies bei Brustkrebs der Fall ist. Wird das bei den Atombombenüberlebenden, die eine niedrige Spontanrate aufweisen, beobachtete zusätzliche relative Risiko auf westliche Bevölkerungen übertragen, die allgemein hohe Spontanraten zeigen, so resultiert eine weit höheres absolutes Risiko als bei einer direkten Übertragung des absoluten Risikos.
Für den Fall, dass lediglich ein relatives Risikomodell zur Verfügung steht und dennoch der Ansatz eines additiven Risikotransfers verfolgt werden soll, kann der Schätzwert, der aus dem relativen Risikomodell resultiert, durch Multiplikation mit einem geeigneten so genannten Transferfaktor korrigiert werden. Die Höhe des Transferfaktors orientiert sich üblicherweise an dem Verhältnis des spontanen Brustkrebsrisikos der Studienpopulation zum Spontanrisiko der Bevölkerung, für die das Strahlenrisiko ermittelt werden soll. Dieses Verhältnis beträgt für eine japanische und deutsche Bevölkerung mindestens 1 zu 2. Ein Transferfaktor kann somit konservativ auf ½ angesetzt werden.
Nachdem lange Zeit unklar war, welches der beiden Transfermodelle verwendet werden soll, mehren sich in jüngerer Zeit die Hinweise, dass das additive Transfermodell besser mit den Beobachtungen übereinstimmt [30]. Auch Preston et al. empfehlen den additiven Ansatz für den Risikotransfer [26]. Ihr bevorzugtes Risikomodell ist ein absolutes Modell, welches im Wesentlichen an die Daten der japanischen Atombombenüberlebenden und die Daten der US-amerikanischen ehemaligen Tuberkulose-Patientinnen (Behandlung in den 1920er bis 1950er Jahren) aus Massachusetts angepasst wurde.
- 3.2
- Analyse der Inzidenzdaten der LSS-Kohorte von Land et al. (2003)
Dieser Report [27] über die Brustkrebsinzidenz bei den Atombombenüberlebenden mit Follow-up von 1950 bis 1990 ist der aktuellste einer Reihe fortlaufender Berichte (1977, 1979, 1987, 1994) und verwendet Daten des Tumor and Tissue Registry Office (im Gegensatz hierzu gingen in die Meta-Analyse von Preston et al. die Daten der Tumorregister von Hiroshima und Nagasaki ein, die Krebsfälle seit 1958 erfassen).
In die Analyse gehen 1093 Brustkrebsfälle ein (Diagnosealter 24 bis 98 Jahre). Mehr als die Hälfte aller neu (d.h. zwischen 1986 und 1990) registrierten Fälle wurden bei Frauen diagnostiziert, die bei Exposition unter 20 Jahre alt waren.
Land et al. verwenden in ihrer Analyse relative Risikomodelle, die neben der Organdosis auch vom Expositionsalter und/oder vom erreichten Lebensalter abhängig sind. Wie in den meisten Analysen zu strahleninduziertem Brustkrebs wird keine Abweichung von der Linearität der Dosis-Effekt-Beziehung gefunden. Wie bereits bei früheren Risikoanalysen der LSS-Kohorte, sind sowohl das Expositionsalter als auch das erreichte Lebensalter wichtige Einflussgrößen des zusätzlichen Brustkrebsrisikos.
- 3.3
- BEIR VII (2006)
Das im neuesten Bericht des BEIR-Komitees (BEIR VII Report [30]) sowohl für die Brustkrebsinzidenz als auch für die Brustkrebsmortalität beschriebene absolute Risikomodell orientiert sich an den Ergebnissen der Meta-Analyse von Preston et al. [26] (s. 3.1). Das BEIR VII-Komitee hält, ebenso wie Preston et al. in ihrer Metaanalyse [26], den additiven Ansatz für den Risikotransfer für besser geeignet als die Anwendung eines relativen Risikomodells.
- 3.4
- Aktuelle Analyse der Inzidenzdaten der LSS-Kohorte von Preston et al. (2007)
Grundlage der Berichte zur Krebsinzidenz bei den Atombombenüberlebenden sind die Daten der Tumorregister von Hiroshima und Nagasaki. Der aktuellste, im Jahre 2007 veröffentlichte Report bezieht sich auf den Follow-up-Zeitraum 1958 bis 1998 [28]. In die Analyse gingen 1073 Brustkrebsfälle bei 62 525 weiblichen Atombombenüberlebenden mit Dosisschätzungen ein. Davon traten 546 Fälle bei den 35 883 Frauen auf, für die eine gewichtete Brustdosis von weniger als 5 mGy abgeschätzt wurde (Kontrollgruppe). In der Expositionsgruppe (> 5 mGy) werden 27 % der Brustkrebsfälle auf die Strahlung zurückgeführt ("attributable fraction").
Die Autoren geben zwei Modelle für das Brustkrebsrisiko nach Strahlenexposition an: ein relatives Risikomodell in Abhängigkeit vom erreichten Lebensalter sowie ein absolutes Risikomodell, welches sowohl von erreichten Lebensalter als auch vom Expositionsalter abhängig ist.
- 3.5
- Risikoabschätzung für Frauen, die an einem Mammographie-Screening teilnehmen, nach den aktuellen Risikomodellen
Als Maß für das Strahlenrisiko infolge eines Mammographie-Screenings wird üblicherweise das zusätzliche Lebenszeitrisiko verwendet. Darunter versteht man das zusätzliche Risiko, infolge einer Strahlenexposition bis zum Lebensende an Brustkrebs zu erkranken (siehe SSK-Stellungnahme [5, 31].
In einer aktuellen Publikation [31], die die oben genannten Publikationen aus jüngerer Zeit berücksichtigt, wurden Werte für das zusätzliche Lebenszeitrisiko für Frauen, die ab 50 Jahren an einem Mammographie-Screening (bis 69 in zweijährigem Abstand) teilnehmen, von zwischen 0,01 und 0,1 % bestimmt (zum Vergleich: das Risiko, bis zum Lebensende „spontan“ an Brustkrebs zu erkranken, beläuft sich für eine 50-Jährige auf 8,8 %). Pro Mammographie-Untersuchung (in zwei Ebenen) wurde dabei – analog zur SSK-Publikation [5] – eine Parenchymdosis von 4 mGy zugrunde gelegt. Da sich die Hinweise auf ein additives Transfermodell verdichten, wurde ein Transferfaktor von ½ auf die relativen Risikoabschätzungen der LSS-Kohorte angewendet. Des Weiteren wurde von einem linearen Zusammenhang zwischen Dosis und Krebsrisiko ohne Annahme einer Schwellendosis (linear no threshold, LNT) ausgegangen.
In der SSK-Stellungnahme zum Mammographie-Screening aus dem Jahr 2002 [5] sind ebenfalls Werte für das zusätzliche Lebenszeitrisiko einer 50-Jährigen, die bis zum 70. Lebensjahr im zweijährlichen Abstand Screening-Mammographien erhält, von 0,01 % bis 0,1 % angegeben. Zu beachten ist, dass bei der aktuellen Analyse [31] bei den auf relativen Risikomodellen beruhenden Abschätzungen für die LSS ein Transferfaktor von ½ angewendet wurde. Wird dagegen der relative Ansatz für den Risikotransfer auf die deutsche Bevölkerung verfolgt, so verdoppeln sich die für die nach den Modellen der LSS abgeschätzten Werte für das zusätzliche Lebenszeitrisiko. Dennoch bliebe auch dann die in der SSK-Stellungnahme [5] geäußerte Schlussfolgerung, „dass der zu erwartende Nutzen das geringe Risiko durch die Strahlenexposition überwiegt“, bestehen.
- 4.
- Erkenntnisse zum Einfluss technologischer Veränderungen auf die Risikoschätzungen
Im Mammographie-Screening in Deutschland werden vereinzelt noch analoge Film/Folien- Systeme, überwiegend jedoch digitale Systeme verwendet. Bei den digitalen Systemen kommen, von einzelnen Spezialsystemen abgesehen, zwei Techniken zum Einsatz:
- •
- Speicherfolien (CR), die an Stelle von Film-Folienkombinationen in konventionellen Mammographiesystemen Verwendung finden und
- •
- Digitale Direkt-Mammographiesysteme auf Selen (aSe/aSi)- oder Cäsiumjodid (CsI/aSi)-Basis (DR)3.
Eine technische Übersicht hierzu ist in der SSK-Stellungnahme zur digitalen Mammographie in der kurativen Anwendung und im Screening [32] enthalten, die Erkenntnisse haben sich seitdem nicht wesentlich verändert.
Deutlich anders stellt sich jedoch heute die Situation in Deutschland in Bezug auf die Anwendungshäufigkeit der verwendeten Gerätetechniken dar. Die digitale Mammographie kommt zunehmend sowohl im kurativen Bereich als auch in den Screening-Einheiten zur Anwendung. Ein gemischter Betrieb digital/analog innerhalb einer Screening-Einheit ist nicht zulässig.
Die Anzahl der digital arbeitenden Zentren unterscheidet sich innerhalb der einzelnen Bundesländer. Insgesamt ergibt sich für Deutschland z. Zt. folgende Situation (Angaben der Kooperationsgemeinschaft Mammographie, Stand 13. März 2008): 347 Geräte insgesamt, davon 305 Geräte digital (88 %) und 42 Geräte analog (12 %). Bei den digitalen Geräten kommen 180 CR-Systeme und 125 DR-Systeme zum Einsatz. Bei 5 der DR-Systeme handelt es sich nicht um Vollfeld-Systeme, sondern um Scanner, die die Brust schlitzförmig abtasten.
Ein direkter Vergleich des Dosisbedarfs bei identischer diagnostischer Bildqualität zwischen analogen und digitalen Systemen ist nach wie vor schwierig durchzuführen und zu bewerten. Durch die Detektortechnik und Nachverarbeitung stellen sich digitale Bilder bei der Betrachtung grundlegend anders dar als Film/Folien-Aufnahmen. Die Ergebnisse von Messungen an Phantomen zur Niedrig- und Hochkontrastauflösung lassen sich nicht direkt auf Patientenaufnahmen übertragen. Es ist zu vermuten, dass DR- gegenüber CR-Systemen eine Dosisreduktion ermöglichen. Die Literaturdaten gehen von einem ähnlichen Dosisbedarf für die DR-Systeme aus aSe/aSi- und CsI/aSi-Detektoren aus, mit einer Dosisreduktion gegenüber Film/Folien Systemen von ca. 25 % [33] bzw. 27 % [34]. Die derzeitig verbreiteten CR-Systeme bieten bis auf einzelne Neuentwicklungen in Bezug auf die Dosis keinen Vorteil gegenüber Film/Folien-Systemen. Zurzeit wird, auf Grund der Vorgabe des BMU, bei den bisher schon zum Screening zugelassenen digitalen Systemen ab März 2007 eine zusätzliche Prüfung des Kontrastauflösungsvermögens mit dem Prüfkörper entsprechend den European Guidelines for Quality Assurance in Breast Cancer Screening and Diagnosis [35] vorgeschrieben.
In der früheren Stellungnahme der Strahlenschutzkommission [5] wurde von einer Organdosis für eine Untersuchung (beide Mammae in 2 Ebenen = 4 Aufnahmen) von 4 mSv ausgegangen. Aktuelle Erhebungen und Studien geben dagegen eine effektive Dosis von 0,5 mSv [36] bis 0,7 mSv [37] an. Sie liegen damit nach Umrechnung der effektiven Dosis in eine Organdosis (unter Annahme der Gewebewichtungsfaktoren aus ICRP60 [38]) in vergleichbarer Größe.
- 5.
- Grundlagen einer Evaluierung von Screening-Programmen
Nach den European Guidelines for Quality Assurance in Breast Cancer Screening and Diagnosis [35] wird bei der Evaluierung von Screening-Programmen zwischen sogenannten Performance Indicators (im Folgenden Prozessindikatoren genannt) und Impact Indicators (im Folgenden Wirksamkeitsindikatoren genannt) unterschieden. Die Überwachung der Prozessindikatoren soll nach den European Guidelines in der Zuständigkeit der Projektverantwortlichen liegen. Die Evaluierung der Wirksamkeit des Screenings in Hinblick auf Mortalität und Nutzen-Risiko-Verhältnis hingegen erfordert die Anwendung komplexer epidemiologischer und statistischer Methoden. Dies impliziert, dass die Evaluierung der Wirksamkeit in den Händen von Wissenschaftlern mit der entsprechenden Expertise liegen sollte. Wegen möglicher Interessenskonflikte ist eine Evaluierung der Wirksamkeit unabhängig von den am Screening-Programm Beteiligten zu favorisieren [39].
Die in den European Guidelines festgelegten Prozessindikatoren umfassen z.B.
- •
- Teilnahmequote,
- •
- Anteil der Frauen, bei denen Screening-Mammographieaufnahmen wegen technischen Problemen wiederholt werden mussten,
- •
- Anteil der Frauen, die zur Abklärungsdiagnostik eingeladen wurden,
- •
- Anteil der Frauen, die invasiven diagnostischen Prozeduren unterzogen wurden,
- •
- Verhältnis von benignen und malignen Biopsieergebnissen,
- •
- Spezifität des Screening-Tests,
- •
- Dauer des Intervalls zwischen Screening und Mitteilung des Ergebnisses,
- •
- Dauer des Intervalls zwischen Screening und Beginn der Abklärungsdiagnostik etc.
Für die meisten dieser Indikatoren sind Zielkorridore festgelegt [35].
Ziel der Früherkennung von Brustkrebs durch Mammographie-Screening ist die deutliche Senkung der Brustkrebssterblichkeit in der anspruchsberechtigten Bevölkerungsgruppe. Bei der Evaluierung der Wirksamkeit des Screening-Programms ist daher die Brustkrebsmortalität ein zentraler Endpunkt. Dabei ist zu beachten, dass sich eine erkennbare Reduktion der Mortalität in der Zielbevölkerung erst langfristig zeigen kann. Ihr Nachweis benötigt eine lange Nachbetrachtungszeit (Follow-up), die Akquise von Daten aus verschiedenen Quellen, wie Krebsregistern und Einwohnermeldeämtern, und effiziente Evaluierungsverfahren zur Bestimmung der Auswirkungen des Screenings bzw. anderer Faktoren auf die Mortalität. Um bereits vor dem Eintreten der Mortalitätsreduktion erste Hinweise auf die Wirksamkeit des Programms zu erlangen, werden häufig Ersatz-Endpunkte (Surrogat-Endpunkte) für die Evaluierung herangezogen, die Vorhersagen über die erwartete Mortalitätsentwicklung erlauben sollen [35].
- 5.1
- Surrogat-Endpunkte zur Evaluierung der Wirksamkeit
Als Surrogat-Endpunkte kommen entsprechend den European Guidelines in Betracht: Intervall-Karzinomrate (d.h. Anteil der Karzinome bei Screening-Teilnehmerinnen, der außerhalb der Screening-Untersuchungen entdeckt wird); Brustkrebs-Detektionsrate (Anteil der entdeckten Tumoren in Bezug auf die Basisinzidenz); Tumorstadium zum Zeitpunkt der Diagnose von im Screening entdeckten Tumoren (z.B. Anteil von im Screening entdeckten Tumoren < 10 mm; Anteil von im Screening entdeckten invasiven Tumoren, Anteil von im Screening entdeckten Tumoren mit Lymphknotenbefall [35]). Es sollten zusätzlich die Stadien der Intervallkarzinome charakterisiert werden.
Der Endpunkt „Tumorstadium“ zielt darauf ab, dass durch die Screening-Maßnahmen eine Stadienverschiebung, hin zu frühen, prognostisch günstigeren Tumorstadien, erreicht werden soll („Linksverschiebung der Stadien“). Generell sind in einem Screening detektierte Brusttumoren kleiner, eher low grade, seltener mit Lymphknotenbefall assoziiert [40, 41] und auch auf molekularer Ebene unterscheidbar [42]. Dabei sind jedoch verschiedene Effekte zu beachten, die zu einer Verzerrung (Bias) und Fehlinterpretation führen könnten: Aufgrund von "lead-time bias4", "length-time bias5" und Überdiagnose6 steigt der Anteil von prognostisch günstigen Tumoren zwangsläufig an, ohne dass dies verlässliche Aussagen darüber zulässt, ob die prognostisch ungünstigen Stadien in der Zielbevölkerung relevant zurückgehen. Auch wenn die angestrebte Linksverschiebung der Stadien zu einer Verlängerung der Überlebenszeiten der im Screening entdeckten Frauen mit Brustkrebs führt, ist unklar, ob dies auch zu einer Reduktion der Sterblichkeit führen wird. Analysen, die auf der Sterblichkeit von Brustkrebsfällen oder der Überlebenszeit beruhen, sind nur dann in Hinblick auf die Wirksamkeit des Screening-Programms aussagekräftig, wenn lead-time und length-time bias adäquat berücksichtigt werden (z.B. [43]).
Um zu sehen, ob es im Zuge der Screening-Runden zu einem geringeren Auftreten der fortgeschrittenen und prognostisch ungünstigen Stadien kommt, welches letztlich die Voraussetzung für eine Mortalitätsreduktion ist, müssen nicht nur die relativen Anteile der beobachteten Tumorstadien, sondern auch die Inzidenzen für die einzelnen Tumorstadiengruppen in der anspruchsberechtigten Bevölkerung bestimmt werden [35].
- 5.2
- Mortalitätsevaluierung
Der Nachweis einer aufgrund der Einführung des bevölkerungsbasierten Screenings veränderten Brustkrebs-Mortalität in der Zielbevölkerung ist kompliziert. Wenn – wie in Deutschland erfolgt – die Einführung nicht randomisiert oder in Hinblick auf eine spätere Evaluierung kontrolliert geschieht (Kapitel 6), sondern die zeitliche Abfolge mehr oder minder stark strukturelle Unterschiede zwischen Regionen widerspiegelt, ist die Evaluierung besonders erschwert.
Bei einer reinen Betrachtung der Brustkrebs-Mortalitätsentwicklung in der Gesamtbevölkerung vor und nach Einführung der Screening-Maßnahmen (Trendanalyse) ist zu bedenken, dass die altersstandardisierten Mortalitätsraten ohnehin gegenwärtig sinken. Auch in anderen Ländern wurden sinkende Mortalitätsraten und auch Verschiebung der Tumorstadien hin zu frühen Stadien zum Teil schon vor Einführung eines bevölkerungsbasierten Screenings beobachtet und mit einer erhöhten Aufmerksamkeit (Awareness) im Zuge der Diskussionen um die Einführung des Screenings und zum Teil einer vermehrten Nutzung des grauen Screenings in Verbindung gebracht [44]. Screening-bedingte Effekte von diesen und möglichen anderen Effekten, die nicht auf bevölkerungsbasiertem Screening beruhen, zu unterscheiden, erfordert ausgefeilte epidemiologische Methoden. Zudem dauert es viele Jahre, bis Mortalitätseffekte sichtbar werden können, da die meisten der in den ersten Jahren nach Screening-Beginn erfolgenden Todesfälle auf Brustkrebserkrankungen zurückzuführen sein werden, die vor Screening-Beginn diagnostiziert wurden. In einigen Studien wurde versucht, durch mathematische Modelle die ohne Screening zu erwartende Brustkrebsmortalität abzuschätzen, und diese mit der unter Screening beobachteten Brustkrebsmortalität zu vergleichen [35].
Bei einem Vergleich von Mortalitätstrends in Regionen mit gegenüber Regionen ohne bevölkerungsbasiertem Screening (oder früher Einführung des Screenings gegenüber später Einführung) besteht zudem die Möglichkeit, dass sich die Brustkrebsrisiken und/oder Therapiemaßnahmen systematisch unterscheiden, d.h. die Brustkrebsmortalitäten a priori nicht vergleichbar sind. So ist zum Beispiel bekannt, dass das Brustkrebsrisiko sich in städtischen und ländlichen Regionen unterscheidet [z.B. 45]. Für die Mortalität finden sich ebenfalls deutliche geographische Unterschiede; so schwankt die alterstandardisierte Brustkrebsmortalität zwischen den deutschen Bundesländern zwischen etwa 20 und 30/100 000 [8]. Diese Unterschiede dürften zum einen auf tatsächliche Inzidenzunterschiede, zum anderen aber auch auf Unterschiede in der Versorgung und Therapie von Brustkrebspatientinnen zurückzuführen sein.
Trotz der erwähnten Einschränkungen basieren viele Untersuchungen zu den Auswirkungen eines organisierten Screenings auf solchen Vergleichen von zeitlichen Trends [35, 44]. Um Einflüsse von Risikofaktoren, geographischen Unterschieden und Versorgungsunterschieden zu berücksichtigen, sollten jedoch Evaluierungsmodelle verwendet werden, die solche möglicherweise verfälschende Faktoren (Confounder) weitestgehend einbeziehen.
Kohortenstudien erlauben gezielt die Entwicklung von denjenigen Krebserkrankungen zu untersuchen, die nach Einführung des organisierten Screenings unter den Teilnehmerinnen oder den zum Screening eingeladenen Frauen diagnostiziert wurden. Im Gegensatz zu Analysen der Brustkrebsmortalität in der Gesamtbevölkerung benötigt die Untersuchung einer solchen inzidenzbasierten Mortalität einen Datenabgleich, der eine Zuordnung der Screening-Historie zu jedem Brustkrebsfall ermöglicht. Im Idealfall sollten die betroffenen Fälle verglichen werden mit Fällen von Frauen, die (noch) nicht zum Screening geladen wurden, aber in Hinblick auf Geburtsjahrgang, Wohnort und anderen Risiko-beeinflussenden Faktoren möglichst ähnlich sind. Im Gegensatz zu cluster randomized trial-Studien, die schon bei der Einführung des organisierten Screenings im Hinblick auf die später zu erfolgende Evaluierung randomisiert Gruppen von Eingeladenen und Gruppen von Nicht-Eingeladenen bildeten, wie das in Finnland der Fall war [46], ist bei Kohortenstudien allerdings mit Strukturungleichheiten zu rechnen. Diese Ungleichheiten in Hinblick auf prognostisch relevante Faktoren führen zu einem Confounding, welches bereits in der Studienplanung präzise berücksichtigt werden muss. In Kohortenstudien können Vergleiche mit historischen Kontrollen oder Kontrollen aus anderen Regionen durchgeführt werden [44, 47, 48]. Die oben beschriebenen Einschränkungen hinsichtlich Screening-unabhängiger Veränderungen der Brustkrebsmortalität und regionaler Unterschiede in den Risikofaktoren gelten auch hier. Wenn keine adäquaten Kontrollpopulationen verfügbar sind, ist es möglich, die erwarteten Mortalitätsraten in Abwesenheit von Screening zu modellieren [49].
Die Wirksamkeit von Screening-Maßnahmen kann auch mit Fall-Kontroll-Studien überprüft werden. Gabe und Duffy [44] listen sieben Fall-Kontrollstudien auf, die zwischen 1990 und 2004 die Wirksamkeit von bevölkerungsbasiertem Screening untersuchten; 2006 bis 2008 kamen weitere Studien hinzu [50 - 54]. Im allgemeinen werden als Fälle Frauen definiert, die an einem Brustkrebs verstorben sind, der nach Einführung des Screening-Programms diagnostiziert wurde; als Kontrollen dienen Frauen, die zum Zeitpunkt des Todes des zugehörigen Falls noch leben, und hinsichtlich verschiedener Faktoren wie Alter, Wohnort, soziale Schicht etc. möglichst mit dem zugehörigen Fall übereinstimmen. Die meisten der Studien bestimmen das odds ratio (OR) für Tod durch Brustkrebs bei Frauen, die mindestens eine Screening-Untersuchung mitgemacht haben, gegenüber Frauen, die nicht am Screening teilgenommen haben. In einer neueren Studie wurde auch der Einfluss der Screening-Intensität analysiert [54]. Wegen des Bezugs auf Teilnehmerinnen (anstatt Eingeladene) sind die beobachteten Effekte größer als bei randomisierten Studien. Zudem werden die Studien anfällig für den so genannten self-selection bias. Dieser impliziert, dass sich die Risikosituation zwischen Frauen, die am Screening teilnehmen, und solchen, die trotz Einladung nicht teilnehmen, unterscheidet. Der self-selection bias kann sich in beide Richtungen auswirken: In einer australischen Studie wurde beobachtet, dass das Vorliegen von bekannten Risikofaktoren, wie z.B. Brustkrebs bei Verwandten ersten Grades, die Bereitschaft zur Teilnahme erhöht [54]; ebenso könnten Frauen mit brustkrebsverdächtigen Symptomen bereitwilliger teilnehmen als symptomlose Frauen, hätten aber ein höheres Risiko. Auf der anderen Seite könnten Teilnehmerinnen ein stärkeres Gesundheitsbewusstsein oder andere Risikofaktoren haben [55]. Dies, und der Effekt, dass Frauen mit Tastbefunden oder bereits erfolgter Brustkrebsdiagnose vom Screening ausgeschlossen werden, z.T. aber dennoch eingeladen wurden, führte in vielen Studien zu der Abschätzung deutlich erhöhter Risiken für eingeladene Nicht-Teilnehmerinnen, an Brustkrebs zu versterben (z.B. [44, 47, 53]). Insbesondere bei einem Vergleich von Fällen und Kontrollen bezüglich der Screening-Häufigkeit besteht die Gefahr eines healthy-screenee bias7 [56].
Für aussagekräftige Fall-Kontroll-Studien ist es wichtig, dass die Daten zu den Screening-Historien von Fällen und Kontrollen möglichst umfassend und fehlerfrei zur Verfügung stehen. Dies kann auf Grund der retrospektiven Erfassung bei den verstorbenen Fällen problematisch sein. Ähnliches gilt für den Nachweis, dass die betroffenen Patientinnen wirklich an Brustkrebs verstorben sind und nicht an anderen Todesursachen, um einen so genannten case ascertainment bias zu vermeiden. Eine Grundvoraussetzung ist auch, dass Fälle und Kontrollen gleichermaßen Zugang zum Screening gehabt haben, was v. a. in der Einführungsphase eines bevölkerungsbasierten Programms schwierig nachzuweisen ist [56]. Schließlich stellt sich die Frage, bis zu welchem Zeitpunkt Screening-Untersuchungen bei den Kontrollen gezählt werden [57]: werden sie unabhängig vom Diagnosezeitpunkt des zugehörigen Falls gezählt, können Kontrollen weitere Untersuchungen anhäufen, wenn ihr Fall schon mit Brustkrebs diagnostiziert wurde; dadurch erhalten Kontrollen höhere Screening-Häufigkeiten und die positiven Effekte werden überschätzt. Legt man für die Kontrollen ein Pseudodiagnosedatum fest, das mit dem Diagnosedatum des zugehörigen Falls übereinstimmt, kann, wie Mikrosimulationen zeigen, ein positiver Effekt unterschätzt werden. Die beste Übereinstimmung in Mikrosimulationen wird erzielt, wenn Screening-Untersuchungen bei Kontrollen bis zu dem Zeitpunkt gezählt werden, an dem die Fälle ohne Screening ihre Diagnose erhalten hätten [57]. Allerdings ist dieser Zeitpunkt nicht bekannt, so dass die Dauer der präklinischen Phase geschätzt werden muss.
Allen Ansätzen ist gemeinsam, dass belastbare Aussagen erst mehrere Jahre nach Screening- und Studienbeginn möglich sind. Aufgrund der mittleren 5-Jahres Überlebensrate von über 80 % [58] sind Beobachtungszeiten von mindestens 5 bis 10 Jahren nötig.
- 5.3
- Mögliche weitere Endpunkte für die Evaluierung der Wirksamkeit
Für den Erfolg eines bevölkerungsbasierten Screenings ist nicht allein die Senkung der Brustkrebsmortalität ausreichend. Gleichzeitig ist eine Minimierung der Belastungen, die mit einem Mammographie-Screening verbunden sein können, zu gewährleisten [1, 59]. Als Endpunkte kommen daher die Rate falschpositiver Befunde und ihre Auswirkungen (z.B. unnötige Biopsien, Angstsituationen, Einfluss auf Bereitschaft, am Screening weiterhin teilzunehmen [60]) in Frage, ebenso wie falschnegative Befunde und mögliche Verzögerung diagnostischer Abklärung von Tastbefunden oder auffälligen Symptomen bei kürzlich erfolgter Screening-Mammographie [61]. Von großem Interesse ist eine Abschätzung der Häufigkeit von Überdiagnosen, da deren Anteil an den detektierten Tumoren in bisherigen Studien als zwischen 3 % und über 50 % abgeschätzt wurde [62]. Allerdings ist eine verlässliche Abschätzung komplex, da konkurrierende Trends sowie lead time-Effekte berücksichtigt werden müssen [63].
Von Interesse ist auch die Frage, ob das so genannte graue Screening durch Einführung des bevölkerungsbasierten Screening-Programms reduziert wird. Erste Erfahrungen aus anderen Ländern zeigen, dass das nicht unbedingt der Fall ist [64]. Interessant wäre auch ein Vergleich von Sensitivität und Spezifität von Mammographieuntersuchungen im Rahmen des bevölkerungsbasierten Programms gegenüber nicht bevölkerungsbasierten Situationen [65], sowie Untersuchungen, ob es durch Einführung des bevölkerungsbasierten Screenings zu einer Veränderung der Strahlenbelastung kommt. Es ist allerdings fraglich, ob die Datenlage in Deutschland eine Analyse des grauen Screenings erlaubt. Schließlich stellt sich die Frage, ob im Screening detektierte Brusttumoren anders therapiert werden (z.B. in Hinblick auf Brusterhalt, Chemotherapie) als außerhalb des Screenings detektierte, und inwieweit mögliche Änderungen unabhängig von der Stadienverschiebung sind.
Da der Erfolg des Screening-Programms sehr davon abhängt, dass ein großer Teil der Anspruchsberechtigten teilnimmt, ist es unter Umständen wichtig, das Teilnahmeverhalten und Gründe für eine Nichtteilnahme zu charakterisieren. Erkenntnisse hieraus können auch bei der Abschätzung eines möglichen self-selection bias bei den Mortalitätsevaluierungen hilfreich sein.
Die Untersuchungen der genannten Endpunkte benötigen voraussichtlich die Erfassung vieler Daten, so dass nicht zu erwarten ist, dass sie auf Ebene der gesamten anspruchsberechtigten Bevölkerung durchführbar sind. Für solche und weitere spezifische Fragestellungen sind kleinere Studien in begrenzten Gebieten besser geeignet.
Bei der Evaluierung von Screening-Maßnahmen wird im Allgemeinen die krankheitsspezifische Mortalität untersucht. Verschiedene Autoren schlagen zusätzlich eine Untersuchung der Sterblichkeit an allen Todesursachen (Gesamtmortalität) vor [59, 66], da diese nicht von Verzerrungen in der Feststellung der Todesursache (case ascertainment bias) betroffen ist. Zudem kann die Gesamtmortalität ein Maß zur Erfassung unerwarteter Nebeneffekte darstellen (z.B. zusätzliche Todesfälle aufgrund von Screening-bedingten diagnostischen und therapeutischen Maßnahmen, oder Verhinderung von Todesfällen, die nicht als krankheitsspezifisch erkannt werden, bei Screening-Teilnehmern) [66]. Die gleichzeitige Erfassung von krankheitsspezifischer Mortalität und Gesamtmortalität kann auch Hinweise auf strukturelle Ungleichheiten zwischen Screening-Teilnehmern und Nicht-teilnehmern (z.B. healthy screenee bias) geben [66].
- 6.
- Spezielle Situation des qualitätsgesicherten Mammographie-Screenings in Deutschland
Das Mammographie-Screening-Programm in Deutschland wird von den Krankenkassen finanziert und in Zusammenarbeit mit den Kassenärztlichen Vereinigungen umgesetzt.
Für die flächendeckende Einführung des Mammographie-Screening-Programms in Deutschland wurde auf Bundesebene zum 1. August 2003 von den Spitzenverbänden der Gesetzlichen Krankenkassen und der Kassenärztlichen Bundesvereinigung (KBV) die Kooperationsgemeinschaft Mammographie (KoopG) in der ambulanten, vertragsärztlichen Versorgung gegründet. Die KoopG ist eine Gesellschaft bürgerlichen Rechts. Die Aufgaben der KoopG umfassen die Koordinierung und Evaluierung des Mammographie-Screening-Programms.
Auf Landesebene ist jeweils die sogenannte Zentrale Stelle für das Einladungswesen zuständig (Abb. 5). Die Zentrale Stelle lädt auf Grundlage von Daten der Einwohnermeldeämter alle Frauen zwischen 50 und 69 Jahren im Abstand von zwei Jahren zur Teilnahme am Mammographie-Screening schriftlich ein. Auf Landesebene spielen zudem die Krebsregister eine wichtige Rolle, da gemäß Krebsfrüherkennungsrichtlinie die Evaluierung des Programms unter Einbeziehung von Daten des zuständigen bevölkerungsbezogenen Krebsregisters zu erfolgen hat.
Regionale Ebene: Die Früherkennungsuntersuchungen finden – möglichst wohnortnah – in zertifizierten Untersuchungszentren statt, den sogenannten Mammographie-Einheiten. Eine oder mehrere Mammographie-Einheiten bilden zusammen mit einer oder mehreren Einheiten zur Abklärungsdiagnostik eine Screening-Einheit. Die Leitung der Screening-Einheit haben ein bis zwei sogenannte Programmverantwortliche Ärzte (PVA). Der Einzugsbereich einer Screening-Einheit liegt bei 800 000 bis 1 Mio. Einwohnern, wobei die Zielgruppe ca. 100 000 bis 125 000 Frauen (zwischen 50 und 69 Jahren) umfasst. Mehrere Screening-Einheiten bilden wiederum Versorgungsprogramme, die den Gebietsgrenzen der Kassenärztlichen Vereinigungen entsprechen sollen.
Überregionale Ebene: Die einzelnen Screening-Einheiten werden durch die übergeordneten Referenzzentren im Hinblick auf die Qualität der Leistungen unterstützt und kontrolliert. Die Referenzzentren sind für die Fortbildung und Betreuung der am Programm teilnehmenden Ärzte und radiologischen Fachkräfte zuständig. Bundesweit gibt es sechs Referenzzentren (Standorte: Berlin, Bremen, Marburg, München, Münster und Wiesbaden).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- Abb. 5:
- Organisationseinheiten im deutschen Mammographie-Screening-Programm
Eine Besonderheit des deutschen Mammographie-Screening-Programms ist seine relativ rasche flächendeckende Einführung: Die ersten Screening-Einheiten nahmen 2005 ihre Arbeit auf, und bis Mitte 2008 waren 98 % der geplanten Screening-Einheiten zertifiziert [3]. Die rasche Einführung wird die Definition geeigneter Kontrollpopulationen, die (noch) nicht zum Screening eingeladen wurden, bei Evaluierungsversuchen erschweren. Zudem liegen die früh (2005 und Anfang 2006) startenden Screening-Einheiten z.T. in Regionen, die in den Jahren vor Beginn des bundesweiten Mammographie-Screening-Programms an Mammographie-Modellprojekten teilnahmen, so dass hier die Ausganglage eine andere ist als in möglichen Vergleichsregionen mit spätem Beginn. Hingegen liegen die spät beginnenden Regionen bevorzugt in Ostdeutschland, wo sich in Hinblick auf Inzidenz und Mortalität deutliche Unterschiede im Vergleich zu Westdeutschland erkennen lassen (s. Kapitel 2). Hinzu kommt, dass es offenbar kleinräumige regionale Unterschiede in der Versorgung gibt, wie sich zum Beispiel daran erkennen lässt, dass bis April 2008 erst 70 % der Mammographie-Einheiten aktiv waren [67]. Insgesamt wurden bis Ende 2007 26 % der anspruchsberechtigten Frauen zum Screening eingeladen [67].
Ein Element der Evaluierung des Mammographie-Screenings – sowohl für Prozess- als auch für Ergebnisqualität – ist die Einbeziehung der epidemiologischen Krebsregister in Deutschland. In Deutschland werden Krebsneuerkrankungen in allen Bundesländern auf Basis von Landeskrebsregistergesetzen erfasst. Krebsregister haben u.a. die Aufgaben, das Auftreten und die Trendentwicklung aller Formen von Krebserkrankungen zu beobachten, insbesondere statistisch-epidemiologisch auszuwerten, vornehmlich anonymisierte Daten für die Grundlagen der Gesundheitsplanung sowie der epidemiologischen Forschung einschließlich der Ursachenforschung bereitzustellen und zu einer Bewertung der Qualität präventiver und therapeutischer Maßnahmen beizutragen. Damit stellen Krebsregister eine wichtige Datenbasis für die Evaluierung des Mammographie-Screenings dar. In Hinblick auf die Evaluierung des Mammographie-Screenings liegt eine Schwierigkeit darin, dass sich die rechtlichen Grundlagen in den Bundesländern bezüglich Erhebungsmodus (Meldepflicht vs. Melderecht), Informationspflicht und Widerspruchsrecht teilweise deutlich unterscheiden (Näheres dazu in [68]). Die nötigen rechtlichen Grundlagen für den Abgleich der am Screening teilnehmenden Frauen und dem jeweiligen Krebsregister (Identifikation von Intervallkarzinomen, Mortalitätsevaluierung) sind noch nicht in allen Bundesländern umgesetzt. Durch die Änderung und Konkretisierung der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Früherkennung von Krebserkrankungen ([69], s. Kapitel 7) dürften wohl in allen Bundesländern weitere gesetzliche Anpassungen erforderlich sein. Auf Grund verschiedener landesgesetzlicher Grundlagen und unterschiedlicher Auffassungen der Datenschutzbeauftragten der einzelnen Länder hinsichtlich der Umsetzung der Richtlinienanforderung, ist zu befürchten, dass dabei unterschiedliche Regelungen in den Ländern getroffen werden, die eine einheitliche Evaluierung des Screenings erschweren oder sogar unmöglich machen. Um dies zu verhindern, ist eine Harmonisierung der Regelungen in den Ländern unabdingbar.
- 7.
- Richtlinien zur Evaluierung im deutschen Mammographie-Screening
In der Änderung der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Früherkennung von Krebserkrankungen (vom 15.12.2003) B 4 Buchstabe n [1] ist festgelegt, dass „das Früherkennungsprogramm auf der Basis von anonymisierten und aggregierten Daten quer- und längsschnittlich dahingehend evaluiert wird, inwieweit die angestrebten Ziele erreicht werden konnten. Hierzu sollen, bezogen auf die jeweilige Screening-Einheiten sowie bundesweit und im Rahmen der landesrechtlichen Bestimmungen unter Einbeziehung von Daten des zuständigen bevölkerungsbezogenen Krebsregisters, insbesondere folgende Endpunkte ausgewertet werden:
- 1.
- Einladungsquote
- 2.
- Teilnahmequote
- 3.
- Sterblichkeit an Brustkrebs (Mortalität) in der Zielbevölkerung
- 4.
- Brustkrebsentdeckungsrate im Früherkennungsprogramm
- 5.
- Stadienverteilung der entdeckten Mammakarzinome im Früherkennungsprogramm
- 6.
- Brustkrebsneuerkrankungsrate (Inzidenz) in der Zielbevölkerung
- 7.
- Stadienverteilung der Mammakarzinome in der Zielbevölkerung
- 8.
- Positive Vorhersagewerte der Untersuchungsschritte
- 9.
- Anteil der falschnegativen Diagnosen im Früherkennungsprogramm
- 10.
- Anteil der zur Abklärungsdiagnostik eingeladenen Frauen
- 11.
- Anteil der Karzinome, die vor der Operation durch Stanzbiopsie gesichert wurden.“
Diese Vorgaben weichen von den Vorgaben der Europäischen Leitlinien (s. Kapitel 5) ab, da nicht klar zwischen Prozessindikatoren und Wirksamkeitsindikatoren unterschieden wird. Wie bereits ausgeführt, kann insbesondere der Nachweis der Wirksamkeit des bevölkerungsbasierten Screenings nicht auf Grund einer Deskription der Brustkrebsinzidenz und -mortalität in der Zielbevölkerung und der Stadienverteilung der Mammakarzinome geführt werden. Vielmehr ist durch epidemiologische Methoden der Nachweis zu führen, dass diese Endpunkte günstigere Werte annehmen, als dies ohne die Einführung des Screening-Programms der Fall gewesen wäre.
Da die für die genannten Endpunkte nötigen Daten nur zum Teil den Screening-Einheiten und Referenzzentren zur Verfügung stehen, sind laut Änderung des Bundesmantelvertrags-Ärzte/Ersatzkassen über besondere Versorgungsaufträge im Rahmen des Programms zur Früherkennung von Brustkrebs durch Mammographie-Screening [2], folgende Datenflüsse geplant:
- •
- Daten zur Evaluierung der Einladungsquote und Teilnahmequote übermittelt die Zentrale Stelle an das Referenzzentrum (in anonymisierter Form).
- •
- Daten zur Evaluierung der Brustkrebsentdeckungsrate, der Stadienverteilung der entdeckten Mammakarzinome, der positiven Vorhersagewerte der Untersuchungsschritte, des Anteils der zur Abklärungsdiagnostik eingeladenen Frauen sowie des Anteils der Karzinome, die vor der OP durch Stanzbiopsie gesichert wurden, übermittelt der programmverantwortliche Arzt an das Referenzzentrum (anonymisiert).
- •
- Daten zur Evaluierung der Sterblichkeit an Brustkrebs in der Zielbevölkerung, Brustkrebsneuerkrankungsrate in der Zielbevölkerung sowie Stadienverteilung der Mammakarzinome in der Zielbevölkerung erhält das Referenzzentrum vom regionalen Krebsregister (aggregiert).
- •
- Zur Feststellung des Anteils falschnegativer Diagnosen ist ein regelmäßiger anonymisierter Abgleich mit den Daten des jeweiligen Krebsregisters erforderlich. Dazu sollen in den Zentralen Stellen die Personendaten mit den von den Krebsregistern bundeseinheitlich verwendeten Algorithmen in Kontrollnummern (= Pseudonyme für die Namensbestandteile) überführt werden. Die Zentrale Stelle übermittelt die Kontrollnummern der Teilnehmerinnen mit weiteren Daten an das zuständige Krebsregister, die diese mit in ihrem Datenbestand abgleicht. So können diejenigen Frauen identifiziert werden, die im Krebsregister als Brustkrebsfall gespeichert sind und am Screening teilgenommen haben. Wenn bei einer identifizierten Frau der Tumor nicht zum Zeitpunkt des Screenings entdeckt wurde, handelt es sich um ein Intervallkarzinom. Angaben zu diesen Frauen sollen an das Referenzzentrum übermittelt werden. Über die Screening-Einheit soll die Einwilligung der betreffenden Frauen eingeholt werden, um klinische Daten mit den Röntgenbefunden zusammenzuführen.
Inzwischen stellte sich heraus, dass die geplanten Datenflüsse nicht wie beschrieben umsetzbar sind, da die Krebsfrüherkennungsrichtlinie [1] nicht die Übermittlung aller erforderlichen Daten für den Abgleich zulässt. Daher wurde vom Gemeinsamen Bundesausschuss eine weitere Änderung der Richtlinie beschlossen [69]. Durch das Hinzunehmen von erforderlichen Daten für den Abgleich und durch die Einführung einer zufallsgenerierten Kommunikationsnummer, die keine personenbezogenen Daten enthält und jeweils nur für eine Datenabgleichsrunde gilt, soll der Abgleich zwischen den von den Zentralen Stellen an die Krebsregister übermittelten Daten der Teilnehmerinnen am Screening-Programm und den in den Krebsregistern vorliegenden Daten zu Brustkrebsfällen ermöglicht werden. Dadurch wird die Identifizierung von Intervallkarzinomfällen, also Brustkrebsfällen unter Screening-Teilnehmerinnen, die nicht im Screening, sondern außerhalb im Zeitraum von zwei Jahren nach einer Screening-Mammographie diagnostiziert werden, möglich.
Da in den Krebsregistern der einzelnen Bundesländer Daten zu Diagnosedatum, Tumorstadien, Histologie und eventuellem Todeszeitpunkt für praktisch alle Brustkrebspatientinnen verfügbar sind, und diese Daten für die Identifikation der Intervallkarzinome sowieso abgeglichen werden müssen, bietet es sich an, auch die Datenaufbereitung für die Evaluierung von Nutzen und Risiken des Screening-Programms bei den Krebsregistern zu verankern, selbst wenn theoretisch andere Wege (z.B. individueller Follow-up aller Screening-Teilnehmerinnen, spezielle Brustkrebsregister) möglich wären. Hierfür sprechen nicht nur Gründe der Effizienz und Ökonomie, sondern auch die besondere Stellung der Krebsregister im Hinblick auf den Datenschutz. Bei der Änderung der Krebsfrüherkennungsrichtlinie trägt man dem Rechnung, indem die oben beschriebenen geplanten Datenflüsse auch die Bereitstellung von Daten für die Mortalitätsevaluierung ermöglichen sollen [69]. Es ist für sinnvolle Evaluierungsansätze sicher zu stellen, dass die Zentrale Stelle nicht nur die Daten der Teilnehmerinnen der letzten Screening-Runde an das jeweilige Krebsregister übermittelt, sondern aller Frauen, die jemals am Screening teilgenommen haben, zusammen mit der vollständigen Screening-Historie mit genauen Daten der Untersuchungen. Dadurch können bei der Evaluierung z. B. Brustkrebsfälle nach der Teilnahmehäufigkeit stratifiziert werden, oder durch Analyse der Erkrankungen bei über 70-Jährigen Abschätzungen des lead-time bias vorgenommen werden.
Ist der Abgleich letztendlich realisiert, kann dieser genutzt werden, um die Evaluierung durchzuführen und schließlich weiter zu optimieren. Beim Abgleich der Screening-Kohorte mit den Krebsregistern lässt sich der Datenbestand der Register in drei Gruppen unterteilen:
- 1.
- Brustkrebspatientinnen, deren Brustkrebs im Screening entdeckt wurde (Screening-detektiert),
- 2.
- Brustkrebspatientinnen, die am Screening teilnahmen, deren Tumor aber nicht im Screening entdeckt wurde (Intervallkarzinome), und
- 3.
- Brustkrebspatientinnen, die nicht am Screening teilnahmen.
Diese drei Kohorten könnten im Längsschnitt über das routinemäßige Follow-up der Krebsregister nachbeobachtet werden. Prinzipiell könnten alle weiteren Routine-Parameter der Krebsregister (Inzidenz, Histologie, Alter, Tumorstadien, Überleben etc.) für diese Kohorten untersucht werden.
Die Evaluierung von Nutzen und Risiken inklusive Evaluierung der Brustkrebsmortalität wurde in der Krebsfrüherkennungsrichtlinie [1] nicht ausdrücklich genannt. Daher ist es begrüßenswert, dass bei der Änderung der Richtlinie [69] die Notwendigkeit einer wissenschaftlichen externen Evaluierung, inwieweit das Ziel einer Senkung der Brustkrebssterblichkeit erreicht wird, in die Richtlinie aufgenommen wurde.
- 8.
- Möglichkeiten für eine Gesamtevaluierung von Nutzen und Risiken unter den deutschen Bedingungen
Bisher wurde lediglich ein Studiendesign für eine Mortalitätsevaluierung des deutschen Mammographie-Screenings in der Fachliteratur beschrieben [70]. Dieses Design sieht vor, im Rahmen eines geographischen Vergleichs eine Region, in der das flächendeckende Screening früh implementiert wurde (Studienregion), mit einer Region zu vergleichen, in der das flächendeckende Screening spät implementiert wurde (Vergleichsregion). Bei einem angenommenen Abstand zwischen „früh“ und „spät“ von zwei Jahren (d.h. der Dauer einer Screening-Runde), würde zu Programmbeginn die Studienregion in die erste Screening-Runde (Prävalenzrunde) eintreten, während die Vergleichsregion noch kein Screening durchführt und die Ermittlung einer Basisinzidenz ermöglicht. Zwei Jahre nach Programmbeginn tritt die Vergleichsregion in die Prävalenzrunde ein, während die Studienregion in die zweite Screening-Runde eintritt, die sogenannte Inzidenzrunde. In späteren Runden werden in beiden Regionen Inzidenzrunden durchgeführt. Ein Vergleich zwischen den Runden zur Messung des Einflusses auf die Brustkrebsmortalität bringt dann keine zusätzlichen Informationen; im Gegenteil: mögliche Effekte würden sogar verdünnt.
Zur Evaluierung würden also nur Brustkrebsfälle herangezogen, die in den ersten vier Jahren nach Programmbeginn in den Studienregionen auftreten, bzw. in den beiden Jahren vor Programmimplementierung und den beiden Jahren danach in den Vergleichsregionen. Alternativ schlagen die Autoren im Rahmen eines temporalen Vergleichs vor, innerhalb einer Region (z.B. einer Screening-Einheit) die ersten 4 Jahre nach Implementierung (Prävalenzrunde und erste Inzidenzrunde) mit den beiden Jahren vor plus den beiden Jahren nach Implementierung (Basisinzidenz plus Prävalenzrunde) zu vergleichen. In beiden Fällen sollen die Brustkrebsfälle, die in den entsprechenden Zeitfenstern entdeckt wurden, bestimmt und in einem 10-jährigen Follow-up bis zum möglichen Tod der Patientin beobachtet werden. Studien- und Vergleichspopulation sind also die inzidenten Brustkrebsfälle im Alter von 50 bis 69 Jahren, die in einem Zeitraum von mindestens zwei Jahren vor Screeningbeginn und während der ersten beiden Screeningrunden in den betreffenden Regionen innerhalb und außerhalb des Screenings diagnostiziert wurden.
Die SSK hält Ansätze, die die Mortalität unter den diagnostizierten Brustkrebsfällen analysieren, generell nicht für geeignet, die Entwicklung der Brustkrebsmortalität in der Zielbevölkerung nachzuweisen. Aufgrund von lead-time bias, length-time bias und Überdiagnosen werden die im Screening detektierten Tumoren unweigerlich mit einem längeren Intervall zwischen Diagnose und Todeszeitpunkt (und somit zu einem augenscheinlich besseren Überleben zu einem bestimmten Zeitpunkt nach der Diagnose) sowie einem besseren Überleben wegen der günstigeren Prognose der im Screening detektierten Tumoren einhergehen. Stattdessen sollten die Brustkrebs-Todesfälle unter den im Screening detektierten Brustkrebspatientinnen auf die Personenjahre unter Risiko bezogen werden, um bevölkerungsbasierte Mortalitätsraten zu bestimmen.
Es ist gegenwärtig zudem unklar, ob unter den Bedingungen der bislang erfolgten Programmeinführung geeignete Studien- und Vergleichsregionen gefunden werden können, zumal in den Regionen, die das Mammographie-Screening-Programm früh einführten z.T. zuvor Modellprojekte durchgeführt wurden und potentielle Vergleichsregionen v.a. in Ostdeutschland liegen, wo die Hintergrundinzidenzen und -mortalitäten sich deutlich von denen in Westdeutschland unterscheiden. Problematisch könnte auch der relativ geringe Grad der Bevölkerungsabdeckung in der Einführungsphase sein. Schließlich würde bei dem vorgeschlagenen Design der Einfluss einer einzigen Screeningrunde untersucht, wodurch die zu erwartenden positiven Effekte deutlich kleiner wären als in bisher veröffentlichten Studien, und es ist unklar, ob so eine ausreichende statistische Aussagekraft erzielt werden kann. Es kann auch nicht ausgeschlossen werden, dass aufgrund der verbreiteten Anwendung des grauen Screenings die erzielbare Mortalitätsreduktion in Deutschland geringer ist als in anderen Ländern beobachtet.
Nach Ansicht der SSK besteht aufgrund der Bedingungen der Programmeinführung und der deutschen Datenschutzregularien für alle Evaluierungsansätze die Befürchtung, dass mit einem Studiendesign alleine keine abschließend belastbare Aussage zur Wirksamkeit des Screening-Programms möglich ist. Es kann daher sinnvoll sein, mehrere komplementäre Studien zur Mortalitätsevaluierung durchzuführen (z.B. Kohorten- und Fall-Kontrollstudien). Diese sollten nach Möglichkeit auf Basis der gesamten anspruchsberechtigten Bevölkerung durchgeführt werden. Für Studien, in denen Brustkrebserkrankungs- und Todesfälle in Hinblick auf Screeningteilnahme untersucht werden sollen (z.B. Vergleiche von Kohorten mit/ohne Screening), werden die Krebsregister durch die erfolgte Änderung der Krebsfrüherkennungsrichtlinie [69] in die Lage versetzt, die benötigten Daten (Screeninghistorien aller erkrankten Frauen) zu sammeln und zur Verfügung zu stellen. Für Studien, die nichterkrankte Frauen einbeziehen (z.B. Fall-Kontroll-Studien) muss sichergestellt werden, dass die Qualität der Daten zu ihren Screeninghistorien mit der der Daten von erkrankten Frauen vergleichbar ist. Möglicherweise wird dies eine Begrenzung des Umfangs der Studien zur Folge haben. Im Rahmen begrenzter Studien können auch die zusätzlichen Endpunkte (wie in Kapitel 5.3 dargelegt) untersucht werden.
Aufgrund der Fülle von Faktoren, die eine Evaluierung des Nutzens des deutschen Mammographie-Screening-Programms erschweren können, ist eine sorgfältige und breite Studienplanung notwendig. Die SSK empfiehlt daher, einen wissenschaftlichen Beirat aus ausgewiesenen Experten mit der weiteren Konkretisierung der Eckpunkte von erfolgversprechenden Evaluierungsansätzen zu beauftragen.
Literatur
[1] | Änderung der Richtlinien des Bundesausschusses der Ärzte und Krankenkassen über die Früherkennung von Krebserkrankungen vom 15.12.2003 |
[2] | Vertrag zur Änderung des Bundesmantelvertrags- |
[3] | http:// |
[4] | SSK: Anforderungen an die Rechtfertigung individueller Früherkennungsuntersuchungen. Empfehlung der Strahlenschutzkommission, verabschiedet auf der 208. Sitzung am 11./12.07.2006 |
[5] | SSK: Mammographie- |
[6] | European Guidelines for Quality Assurance in Breast Cancer Screening and Diagnosis, 3rd Ed., European Commission, Luxembourg; 1999 |
[7] | Krebs in Deutschland 2003 – 2004. Häufigkeiten und Trends. 6. überarbeitete Auflage, Robert Koch- |
[8] | Todesursachenstatistik des Statistischen Bundesamtes, bereitgestellt durch die Gesundheitsberichterstattung des Bundes (www.gbe- |
[9] | Katalinic A, Stegmaier C, Rawal R, Waldmann A: Weniger Hormonersatztherapie, weniger Brustkrebs in Deutschland? Geburtshilfe und Frauenheilkunde 67 (11):1217- |
[10] | Katalinic A, Rawal R: Decline in breast cancer incidence after decrease in utilisation of hormone replacement therapy. Breast Cancer Res Treat 107:427- |
[11] | Katalinic, A, Stegmaier C, Rawal R, Waldmann A: Weniger Hormonersatztherapie, weniger Brustkrebs in Deutschland? Geburtshilfe und Frauenheilkunde Issue 11 Volume 67, November 2007 |
[12] | Anderson WF, Reiner AS, Matsuno RK, Pfeiffer RM: Shifting breast cancer trends in the United States. J Clin Oncol. 25(25):3923- |
[13] | Kerlikowske K, Miglioretti DL, Buist DS, Walker R, Carney PA: National Cancer Institute- |
[14] | Glass AG, Lacey JV Jr., Carreon JD, Hoover RN: Breast cancer incidence, 1980- |
[15] | Berry DA, Ravdin PM: Breast cancer trends: a marriage between clinical trial evidence and epidemiology. J Natl Cancer Inst. 99(15):1139- |
[16] | Ravdin PM, Cronin KA, Howlader N, Berg CD, Chlebowski RT, Feuer EJ, Edwards BK, Berry DA: The decrease in breast- |
[17] | Katalinic A: Sinkende Mortalität bei steigender Inzidenz beim Mammakarzinom, 28. Deutscher Krebskongress, Berlin, 21. Februar 2008 |
[18] | Hermon C, Beral V: Breast cancer mortality rates are levelling off or beginning to decline in many western countries: analysis of time trends, age- |
[19] | Levi F, Lucchini F, Negri E, La Vecchia C: The fall in breast cancer mortality in Europe. Eur J Cancer 37(11):1409- |
[20] | Botha JL, Bray F, Sankila R, Parkin DM: Breast cancer incidence and mortality trends in 16 European countries. Eur J Cancer 39(12):1718- |
[21] | Becker N, Altenburg HP, Stegmaier C, Ziegler H: Report on trends of incidence (1970- |
[22] | Giersiepen K, Haartje U, Hentschel S, Katalinic A, Kieschke J: Brustkrebsregistrierung in Deutschland: Tumorstadienverteilung in der Zielgruppe für das Mammographiescreening. Deutsches Ärzteblatt 101(30): A2117- |
[23] | Ferlay J, Autier P, Boniol M, Heanue M, Colombet M, Boyle P: Estimates of the cancer incidence and mortality in Europe in 2006. Annals of Oncology Advance Access published February 7 2007 |
[24] | Howe GR, McLaughlin J: Breast cancer mortality between 1950 and 1987 after exposure to fractionated moderate- |
[25] | Preston DL, Shimizu Y, Pierce DA, Suyama A, Mabuchi K: Studies of mortality of atomic bomb survivors. Report 13. Solid cancer and noncancer disease mortality: 1950- |
[26] | Preston DL, Mattsson A, Holmberg E, Shore R, Hildreth NG, Boice JD: Radiation effects on breast cancer risk: a pooled analysis of eight cohorts. Radiat Res 158:220- |
[27] | Land CE, Tokunaga M, Koyama K, Soda M, Preston DL, Nishimori I, Tokuoka S: Incidence of female breast cancer among atomic bomb survivors, Hiroshima and Nagasaki, 1950- |
[28] | Preston DL, Ron E, Tokuoka S, Funamoto S, Nishi N, Soda M, Mabuchi K, Kodama K: Solid cancer incidence in atomic bomb survivors: 1958- |
[29] | UNSCEAR: United Nations Scientific Committee on the Effects of Atomic Radiation: UNSCEAR 2000 Report to the General Assembly, with scientific annexes. Volume I: Sources; Volume II: Effects. United Nations, New York; 2000 |
[30] | BEIR VII: Committee to Assess Health Risks from Exposure to Low Levels of Ionizing Radiation, National Research Council: Health Risks from Exposure to Low Levels of Ionizing Radiation: BEIR VII Phase 2. The National Academies Press, Washington, DC; 2006 |
[31] | Nekolla EA, Griebel J, Brix G: Strahlenrisiko infolge von Mammographie- |
[32] | SSK: Digitale Mammographie in der kurativen Anwendung und im Screening, Stellungnahme der Strahlenschutzkommission, verabschiedet in der 197. Sitzung der Strahlenschutzkommission am 16./17. Dezember 2004 |
[33] | Gosch D: Die Strahlenexposition bei der digitalen Vollfeldmammographie mit einem Selen- |
[34] | Gennaro G, di Maggio C: Dose comparison between screen/film and full- |
[35] | European Guidelines for Quality Assurance in Breast Cancer Screening and Diagnosis, 4th Ed., European Commission, Luxembourg; 2006 |
[36] | SSK: Orientierungshilfe für radiologische und nuklearmedizinische Untersuchungen. Empfehlung der Strahlenschutzkommission, Berichte der Strahlenschutzkommission (SSK) des Bundesministeriums für Umwelt, Naturschutz und Reaktorsicherheit Heft 51, Berlin: H. Hoffmann; 2006 |
[37] | http:// |
[38] | International Commission on Radiological Protection. The 1990 Recommendations of the International Commission on Radiological Protection (ICRP Publication 60). Annals of the ICRP 21 (1- |
[39] | Beich A: Breast Cancer Interests. Letter to the Editor, Brit Med J, http:/www.bmj.com/cgi/eletters/330/7485/220; 2005 |
[40] | Weaver DL, Rosenberg RD, Barlow WE, Ichikawa L, Carney PA, Kerlikowske K, Buist DS, Geller BM, Key CR, Maygarden SJ, Ballard- |
[41] | Wishart GC, Greenberg DC, Britton PD, Chou P, Brown CH, Purushotham AD, Duffy SW: Screen- |
[42] | Sihto H, Lundin J, Lehtimäki T, Sarlomo- |
[43] | Paci E, Coviello E, Miccinesi G, Puliti D, Cortesi L, De Lisi V, Ferretti S, Mangone L, Perlangeli V, Ponti A, Ravaioli A, de' Bianchi PS, Segnan N, Stracci F, Tumino R, Zarcone M, Zorzi M, Zappa M, IMPACT Working Group: Evaluation of service mammography screening impact in Italy. The contribution of hazard analysis. Eur J Cancer 44(6):858- |
[44] | Gabe R, Duffy SW: Evaluation of service screening mammography in practice: the impact on breast cancer mortality. Ann Oncol 16 (Suppl 2): ii153- |
[45] | Reynolds P, Hurley S, Goldberg DE, Anton- |
[46] | Hakama M, Pukkala E, Heikkilä M, Kallio M: Effectiveness of the public health policy for breast cancer screening in Finland: population based cohort study. BMJ 314(7084):864- |
[47] | Swedish Organised Service Screening Evaluation Group: Reduction in Breast Cancer Mortality from Organized Service Screening with Mammography: 1. Further Confirmation with extended data. Cancer Epidemiol Biomarkers Prev 15:45- |
[48] | Olsen AH, Njor SH, Lynge E: Estimating the benefits of mammography screening: the impact of study design. Epidemiology Jul;18(4):487- |
[49] | Sarkeala T, Heinävaara S, Anttila A: Organised mammography screening reduces breast cancer mortality: a cohort study from Finland. Int J Cancer 122: 614- |
[50] | Gabe R, Tryggvadóttir L, Sigfússon BF, Olafsdóttir GH, Sigurdsson K, Duffy SW: A case- |
[51] | Allgood PC, Warwick J, Warren RM, Day NE, Duffy SW: A case- |
[52] | Norman SA, Russell Localio A, Weber AL, Coates RJ, Zhou L, Bernstein L, Malone KE, Marchbanks PA, Weiss LK, Lee NC, Nadel MR: Protection of mammography screening against death from breast cancer in women aged 40- |
[53] | Puliti D, Miccinesi G, Collina N, De Lisi V, Federico M, Ferretti S, Finarelli AC, Foca F, Mangone L, Naldoni C, Petrella M, Ponti A, Segnan N, Sigona A, Zarcone M, Zorzi M, Zappa M, Paci E; IMPACT Working Group: Effectiveness of service screening: a case- |
[54] | Roder D, Houssami N, Farshid G, Gill G, Luke C, Downey P, Beckmann K, Iosifidis P, Grieve L, Williamson L: Population screening and intensity of screening are associated with reduced breast cancer mortality: evidence of efficacy of mammography screening in Australia. Breast Cancer Res Treat 108:409- |
[55] | Phillips N, Coldman A: Comparison of nonbreast cancer incidence, survival and mortality between breast screening program participants and nonparticipants. Int J Cancer 122:197:201; 2008 |
[56] | Cronin KA, Weed DL, Connor RJ, Prorok PC: Case- |
[57] | Connor RJ, Boer R, Prorok PC, Weed DL: Investigation of design and bias issues in case- |
[58] | Kraywinkel K, Nennecke A, Holleczek B, Hense H- |
[59] | Giersiepen K, Hense HW, Klug SJ, Antes G, Zeeb H: Entwicklung, Durchführung und Evaluation von Programmen zur Krebsfrüherkennung – ein Positionspapier. Z. ärztl. Fortbild. Qual. Gesundh.wes. 101:43- |
[60] | Andersen SB, Vejborg I, von Euler- |
[61] | de Gelder R, van As E, Tilanus- |
[62] | Biesheuvel C, Barratt A, Howard K, Houssami N, Irwig L: Effects of study methods and biases on estimates of invasive breast cancer overdetection with mammography screening: a systematic review. Lancet Oncol 8(12):1129- |
[63] | Duffy SW, Lynge E, Jonsson H, Ayyaz S, Olsen AH: Complexities in the estimation of overdiagnosis in breast cancer screening. Br J Cancer, Sep 2 2008. [Epub ahead of print] |
[64] | Boncz I, Sebestyén A, Pintér I, Battyány I, Ember I: The effect of an organized, nationwide breast cancer screening programme on non- |
[65] | Bihrmann K, Jensen A, Olsen AH, Njor S, Schwartz W, Vejborg I, Lynge E: Performance of systematic and non- |
[66] | Black WC, Haggstrom DA, Welch G: All- |
[67] | Graebe- |
[68] | Hentsch S, Katalinic A: Das Manual der epidemiologischen Krebsregistrierung. W. Zuckschwerdt- |
[69] | Beschlussentwurf des Gemeinsamen Bundesausschusses über eine Änderung der Krebsfrüherkennungs- |
[70] | Becker N, Hakama M, Nyström L: Evaluation of effectiveness of quality- |
1 Für eine erleichterte Lesbarkeit wurde darauf verzichtet, jeweils auch die weibliche Form von Berufsbezeichnungen o.ä. anzugeben. Selbstverständlich sind stets beide Geschlechter gemeint.
2 Unter grauem Mammographie-Screening versteht man die unsystematische, nicht bevölkerungsbezogene Durchführung von Mammographien an symptomfreien Frauen, z.B. durch niedergelassene Ärzte im Rahmen von Vorsorgeuntersuchungen. Zum Teil wird dies in der Fachliteratur auch als opportunistisches Screening bezeichnet.
3 Beide Systeme besitzen eine Auslesematrix aus amorphem Silizium (aSi), als Röntgendetektor wird amorphes Selen (aSe) oder ausgerichtetes kristallines Cäsiumjodid (CsI) verwendet.
4 Lead-time bias entsteht in Überlebenszeitanalysen durch die Vorverlegung des Diagnosezeitpunkts, d.h. der Zeitraum zwischen Diagnose und Tod verlängert sich, auch wenn sich am Todeszeitpunkt nichts ändert.
5 Length-time bias entsteht, wenn sich langsam entwickelnde Läsionen eine größere Wahrscheinlichkeit haben, bei der Screeninguntersuchung diagnostiziert zu werden, als schnell wachsende Tumoren. Dies führt zu einer Erhöhung des Anteils prognostisch günstiger Tumoren beim Screening gegenüber diagnostischen Abklärungen von symptomatischen Patienten.
6 Überdiagnose ist ein extremes Beispiel eines length-time bias. Es werden beim Screening Tumoren entdeckt, die zu Lebzeit des Patienten keine klinischen Symptome hervorgerufen hätten. Der Einschluss dieser –prognostisch nicht relevanten – Tumoren in Überlebenszeitanalysen führt zu einer scheinbaren Verbesserung der Überlebenszeiten.