Bekanntmachung einer Stellungnahme mit wissenschaftlicher Begründung der Strahlenschutzkommission - Herz-Kreislauferkrankungen nach zulässigen beruflichen Strahlenexpositionen - vom 19. April 2012
Zurück zur Teilliste Bundesministerium für Umwelt, Naturschutz, Bau und Reaktorsicherheit
Bekanntmachung
einer Stellungnahme mit wissenschaftlicher Begründung der Strahlenschutzkommission
– Herz-Kreislauferkrankungen nach zulässigen beruflichen Strahlenexpositionen – vom 19. April 2012
Vom 17. November 2015
Fundstelle: BAnz AT 04.05.2016 B5
Nachfolgend wird die Stellungnahme mit wissenschaftlicher Begründung der Strahlenschutzkommission (SSK), verabschiedet in der 256. Sitzung der Kommission am 19./20. April 2012, bekannt gegeben (Anlage).
Bonn, den 17. November 2015
RS II 2 - 17027/2
Bundesministerium
für Umwelt, Naturschutz, Bau und Reaktorsicherheit
Im Auftrag
Dr. Helming
Anlage
Herz-Kreislauferkrankungen nach zulässigen beruflichen Strahlenexpositionen
Stellungnahme der Strahlenschutzkommission mit wissenschaftlicher Begründung
Verabschiedet in der 256. Sitzung der Strahlenschutzkommission am 19./20. April 2012
Vorwort
Schon seit langem ist es bekannt, dass Strahlentherapie von Brustkrebs bedingt durch eine hohe Dosis des Herzens zu Herzerkrankungen führen kann. Dies ist auch durch aktuelle Studien bestätigt worden. Es wurde lange Zeit angenommen, dass diese Erkrankungen durch die Schädigung einer großen Anzahl von Zellen hervorgerufen werden und ein deterministischer Effekt sind. Für diesen Effekt wurde eine Schwellendosis von 2 Gy angenommen. Es wurde also angenommen, dass Dosen unterhalb von 2 Gy keine Herzerkrankungen bewirken.
Seit 10 Jahren vermehrt sich allerdings die Evidenz, dass auch niedrigere Dosen unter den Atombombenüberlebenden von Hiroshima und Nagasaki zusätzliche Herz-Kreislauferkrankungen hervorrufen. Sich anschließende epidemiologische Studien beruflich und umweltbedingt exponierter Personen ergaben keine eindeutigen Hinweise auf Herz-Kreislaufrisiken nach Expositionen mit Dosen von einigen hundert Milligray. Allerdings überwog insgesamt die Evidenz für ein erhöhtes Risiko.
Im Jahre 2012 wurden zwei Abschätzungen des Herz-Kreislaufrisikos nach Strahlenexposition mit einigen hundert Milligray veröffentlich. ICRP berechnete, dass nach einer Exposition mit 500 mGy 1 % der Exponierten eine zusätzliche Herz-Kreislauferkrankung entwickeln, und betonte die große Unsicherheit dieser Abschätzung. Demnach ist das Risiko für eine strahlenbedingte Herz-Kreislauferkrankung deutlich geringer als das Risiko für eine Krebserkrankung. Demgegenüber veröffentlichte im gleichen Jahr eine große Gruppe angesehener Experten Rechnungen, nach denen das Risiko für Herz-Kreislauferkrankungen nach einer Exposition mit einer Dosis von 100 mGy vergleichbar oder sogar höher als das Krebsrisiko ist.
Entsprechend der Strahlenschutzverordnung ist der Grenzwert für die Lebenszeitdosis durch berufliche Strahlenexpositionen 400 mGy. Herz-Kreislaufrisiken könnten also eine Bedeutung für die Bewertung dieses Grenzwertes haben. Das Bundesministerium für Umwelt, Naturschutz, und Reaktorsicherheit (BMU) bat die Strahlenschutzkommission um eine Stellungnahme. Zur Bearbeitung des entsprechenden Beratungsauftrags bildete die Strahlenschutzkommission eine Arbeitsgruppe, der die folgenden Mitglieder angehörten:
- –
- Prof. Dr. Guido Hildebrandt, Universitätsklinikum Rostock
- –
- Dr. Peter Jacob, Helmholtz Zentrum München
- –
- Prof. Dr. Christa Meisinger, Klinikum Augsburg, MONICA/KORA Herzinfarktregister und Helmholtz Zentrum München
- –
- PD Dr. Susanne Schultz-Hector, Else Kröner-Fresenius-Stiftung, Bad Homburg von der Höhe
- –
- Prof. Dr. Brigitte Stöver, ehemals Charité Berlin
- –
- Dr. Soile Tapio, Helmholtz Zentrum München
- –
- Prof. Dr. Hajo Zeeb, Leibniz-Institut für Präventionsforschung und Epidemiologie GmbH (BIPS), Bremen.
Bonn, im März 2015
Vorsitzender der | Vorsitzender der |
Herz-Kreislauferkrankungen nach zulässigen beruflichen Strahlenexpositionen
Stellungnahme der Strahlenschutzkommission
Inhaltsübersicht
1 Einleitung
2 Herz-Kreislauferkrankungen in Deutschland – deskriptive Epidemiologie
3 Pathogenese der Herz-Kreislauferkrankungen
4 Mögliche Mechanismen des Einflusses von Strahlenexpositionen auf die Pathogenese von Herz-Kreislauferkrankungen
5 Epidemiologische Studien des Strahlenrisikos
6 Zusammenfassung und Bewertung
1 Einleitung
Hohe Dosen ionisierender Strahlung erhöhen das Risiko für Herz-Kreislauferkrankungen. Neuere Untersuchungen geben Hinweise auf erhöhte Erkrankungsraten auch nach Expositionen mit niedrigeren Dosen als vorher angenommen. Daraufhin hat das Bundesministerium für Umwelt, Naturschutz und Reaktorsicherheit die Strahlenschutzkommission in einem Beratungsauftrag vom 13. Juni 2008 gebeten, zur Gesamtthematik „Strahlenwirkung im Bereich der beruflichen Strahlenexposition“ Stellung zu nehmen. Die Strahlenschutzkommission hat den Abschluss zweier großer europäischer Projekte zur Untersuchung möglicher Wirkungsmechanismen von Strahlenexpositionen mit niedrigen Dosen auf die Entstehung von Herz-Kreislauferkrankungen, CARDIORISK und NOTE, abgewartet, um nunmehr eine erste Bewertung vorzunehmen.
Im Bereich der beruflichen Strahlenexposition spielt neben den Grenzwerten für jährliche Strahlenexpositionen die Begrenzung der Berufslebensdosis eine wichtige Rolle. Nach § 56 der Strahlenschutzverordnung beträgt „der Grenzwert für die Summe der in allen Kalenderjahren ermittelten effektiven Dosen beruflich strahlenexponierter Personen ... 400 Millisievert“. Die vorliegende Stellungnahme bewertet deshalb das mögliche Risiko von Herz-Kreislauferkrankungen nach längerfristigen Strahlenexpositionen mit einer effektiven Dosis von einigen hundert Millisievert.
Die Anzahl der beruflich strahlenexponierten Personen mit Überschreitung des Grenzwertes für die Berufslebensdosis ist gering. Von den 1 134 323 im deutschen Strahlenschutzregister erfassten Personen hatten bis zum Ende des Jahres 2009 nur 112 Personen Meldungen von Dosiswerten mit einer Summe von mehr als 400 mSv. Bei 1 029 Personen lag der Wert oberhalb von 200 mSv.
Die vorliegende Stellungnahme bezieht sich ausschließlich auf Risiken von Herz-Kreislauferkrankungen nach Exposition mit Niedrig-LET-Strahlung (insbesondere Röntgen- und Gammastrahlung) im Bereich einiger hundert Milligray. Risiken durch Neutronenstrahlung oder durch inkorporierte Alphastrahler (z. B. Radon und seine Zerfallsprodukte) werden in der vorliegenden Stellungnahme nicht behandelt.
Die Risikobetrachtungen dieser Stellungnahme beruhen auf der Messgröße Energiedosis, die – anders als die im Strahlenschutz verwendete effektive Dosis – keine Wichtungsfaktoren für verschiedene Strahlenarten oder bestimmte Körperorgane enthält. Für die hier betrachtete Niedrig-LET-Strahlung sind die Zahlenwerte von zitierten effektiven Dosen für homogene Ganzkörperbestrahlungen oder von Organdosen identisch mit den entsprechenden mittleren Energiedosen.
Niedrige Dosen werden international durch Energiedosen kleiner als 100 mGy definiert. In der vorliegenden Stellungnahme wird der Bereich von Energiedosen oberhalb von 1 000 mGy als hoch und Dosen im mittleren Bereich als moderat bezeichnet. Eine Energiedosis von 400 mGy durch Niedrig-LET-Strahlung liegt im unteren Bereich moderater Dosen.
Der Begriff Herz-Kreislauferkrankung bezieht sich im weitesten Sinne auf sämtliche Krankheiten des Herzens und des Kreislaufsystems, die in der internationalen Klassifikation der Krankheiten durch die WHO mit ICD10 100-199 bezeichnet werden. Der Begriff kardiovaskuläre Erkrankungen ist ein Synonym für Herz-Kreislauferkrankungen. In Deutschland bilden die Herz-Kreislauferkrankungen die Haupttodesursachengruppe. Die am besten untersuchten und häufigsten Untergruppen sind
- –
- ischämische Herzerkrankungen (ICD10 120-125) und
- –
- zerebrovaskuläre Erkrankungen (ICD10 160-169),
die auch in dieser Stellungnahme neben der Gesamtheit der Herz-Kreislauferkrankungen gesondert behandelt werden.
Die zur Entstehung strahleninduzierter Herz-Kreislauferkrankungen führenden Mechanismen sind bisher weitgehend ungeklärt. Epidemiologische Studien zum Risiko von Herz-Kreislauferkrankungen nach Strahlenexpositionen mit niedrigen und moderaten Strahlendosen wurden für die Atombombenüberlebenden aus Hiroshima und Nagasaki, die Beschäftigen der Plutoniumproduktionsanlagen von Majak im Südural und für weitere beruflich strahlenexponierte Personen durchgeführt.
Die ICRP weist in ihrem Statement vom 21. April 2011 darauf hin, dass die Schwelle für die Induktion von Herz-Kreislauferkrankungen so niedrig wie 500 mGy sein könne. Hierbei definiert ICRP eine Schwelle durch denjenigen Dosiswert, unterhalb dessen die betrachtete Krankheit bei weniger als einem Prozent der exponierten Personen zusätzlich zur Spontanrate auftritt. Diese aktuelle Empfehlung unterstreicht die Wichtigkeit der Analyse vorliegender Studien auch in Bezug auf die Form der Dosis-Wirkungsbeziehung im Bereich moderater Dosen.
2 Herz-Kreislauferkrankungen in Deutschland – deskriptive Epidemiologie
Der Begriff Herz-Kreislauferkrankung erfasst im weitesten Sinne sämtliche Krankheiten des Herzens und des Blutkreislaufsystems. Laut Statistischem Bundesamt waren im Jahr 2008 in Deutschland 42 % der Todesfälle auf Herz-Kreislauferkrankungen zurückzuführen; die altersstandardisierte Herz-Kreislaufmortalität lag bei ca. 434 Fällen je 100 000 Einwohner.
Ischämische Herzerkrankungen lagen ca. 17 % der Todesfälle bei den Männern bzw. 15 % der Todesfälle bei den Frauen zu Grunde; insgesamt 6 % der verstorbenen Männer und 9 % der verstorbenen Frauen starben an einer zerebrovaskulären Erkrankung.
Während Daten zur Herz-Kreislaufmortalität über die Todesursachenstatistik des Statistischen Bundesamtes verfügbar sind, liegen für Deutschland keine Zahlen zur Prävalenz und Inzidenz für Herz-Kreislauferkrankungen vor. Über das Augsburger Herzinfarktregister bzw. das Ludwigshafener Schlaganfallregister werden bevölkerungsbasierte Daten erhoben, sodass bundesweite Schätzungen zur Inzidenz und Prävalenz für diese beiden Erkrankungen möglich sind.
Unter den ischämischen Herzerkrankungen spielt der akute Myokardinfarkt eine vorrangige Rolle. Sowohl bei Männern als auch bei Frauen nimmt die Herzinfarkthäufigkeit mit dem Alter zu. Die meisten Infarkte treten bei über 85-jährigen Männern und Frauen auf. Im Kalenderjahr 2008 ereigneten sich bei den etwa 42 Millionen weiblichen Einwohnern Deutschlands 104 000 und bei den 40 Millionen männlichen Einwohnern 145 000 akute Myokardinfarkte.
Der Schlaganfall ist die häufigste zerebrovaskuläre Erkrankung. In den Jahren 2006 und 2007 lag die altersadjustierte Anzahl von Neuerkrankungen je 100 000 Personenjahre bei 146. Besonders deutlich ist die Altersabhängigkeit des Schlaganfalls: die Inzidenzrate stieg für Männer und Frauen insgesamt von 9 je 100 000 Personenjahre in der Altersgruppe 25 – 34 Jahre auf 1 672 je 100 000 Personenjahre bei den über 85-Jährigen. In der Gruppe der über 65-Jährigen traten insgesamt mehr als 70 % aller Schlaganfälle auf.
Vor dem Hintergrund der demografischen Entwicklung in Deutschland wird mutmaßlich die Anzahl an Herzinfarkt- und Schlaganfallpatienten in den nächsten Jahren deutlich zunehmen.
3 Pathogenese der Herz-Kreislauferkrankungen
Für die Entstehung kardiovaskulärer Erkrankungen sind zahlreiche potenziell modifizierbare Risikofaktoren verantwortlich. Als „klassische Risikofaktoren“ kann man Rauchen, Hyperlipidämie, Hypertonie und Diabetes mellitus bezeichnen; weitere wichtige Risikofaktoren sind Übergewicht/Adipositas und körperliche Inaktivität. Für die Entwicklung von kardiovaskulären Erkrankungen ist weniger der einzelne Risikofaktor relevant, sondern ihre Summe aus Alter, Geschlecht und den modifizierbaren Faktoren. Die meisten Menschen, die kardiovaskuläre Erkrankungen erleiden, weisen verschiedene Risikofaktoren auf, die miteinander interagieren und zu einem Gesamtrisiko kumulieren.
Bei der Entstehung arteriosklerotischer Plaques spielen lokale und systemische Faktoren eine Rolle. Lokale Turbulenzen des Blutflusses, die für das typische Verteilungsmuster arteriosklerotischer Plaques verantwortlich sind, führen im Zusammenspiel mit erhöhtem Lipidgehalt des Blutes (insbesondere LDL) zur Initiierung einer lokalen Entzündungsreaktion in der Gefäßwand. Begleitet von einer Kaskade entzündlicher Signale sind Monozyteninfiltration in die Gefäßwand, Umwandlung in Makrophagen und dann in Schaumzellen, Lipidablagerungen und Einwanderung und Aktivierung von glatten Muskelzellen die wesentlichen Schritte der Entstehung der typischen arteriosklerotischen Plaques des Menschen. Trotz intensiver experimenteller Forschung ist der Ablauf an keinem Tiermodell exakt reproduzierbar.
Klinisch bleibt der arteriosklerotische Plaque häufig über lange Zeit – nicht selten über Jahre hinweg – symptomlos. Erst eine Destabilisierung des Plaques, die schließlich zur Ruptur seiner Kapsel, zum direkten Kontakt von Blut und Plaqueinhalt und zur Thrombusbildung führt, löst die klinische Symptomatik des Gefäßverschlusses aus.
Die klinische Symptomatik von Herzinfarkt oder Schlaganfall wird durch eine lokale Hypoxie, d. h. durch die mangelnde Gewebsperfusion in der Endstrombahn ausgelöst. Erst seit kurzem verfügbare bildgebende Verfahren erlauben die einfache Darstellung und Quantifizierung z. B. der Myokardperfusion und haben das Augenmerk auf einen mindestens verstärkenden Beitrag kapillärer Perfusionsstörungen zum Gesamtbild der ischämischen Herz-Kreislauferkrankungen gelenkt. Eine Bewertung von deren Rolle steht aber noch ebenso aus wie ein Verständnis ihrer Entstehungsmechanismen. Da chronisch progressive Mikrozirkulationsstörungen eine gut bekannte, wenngleich mechanistisch weitgehend unverstandene Folgeerscheinung therapeutischer Strahlendosen sind, kann ein Beitrag unmittelbarer Strahlenwirkungen am Kapillarbett auch im Bereich von Dosen < 500 mGy nicht grundsätzlich ausgeschlossen werden.
4 Mögliche Mechanismen des Einflusses von Strahlenexpositionen auf die Pathogenese von Herz-Kreislauferkrankungen
Die Entstehungsgeschichte des Infarkts oder Schlaganfalls bietet an vielen Schritten mögliche Interaktionspunkte mit in vitro bekannten Strahlenwirkungen, sodass sowohl eine auslösende als auch eine beschleunigende Wirkung der Strahlung denkbar sind. Dennoch ist über die grundlegenden biologischen Wirkmechanismen von Strahlenexposition im niedrigen Dosisbereich auf die Pathogenese von Herz-Kreislauferkrankungen nur wenig bekannt. Es ist aber wahrscheinlich, dass strahleninduzierte Entzündungsvorgänge in hohem Maße zu der Entwicklung einer Arteriosklerose beitragen.
Aufgrund der jahrzehntelangen multifaktoriellen Entstehungsgeschichte arteriosklerotischer Veränderung, der hohen „spontanen“ Häufigkeit in der Bevölkerung und der Unabhängigkeit des klinisch-morphologischen Erscheinungsbildes von der Art der Auslösung sind mechanistische Studien zur Aufklärung des Strahlenrisikos notwendig. Zellkulturen in vitro können aufgrund der Chronizität der Entstehungsgeschichte bestenfalls Hinweise zu isolierten Einzelprozessen liefern. Experimentelle Tiermodelle stellen insofern eine wichtige Erkenntnisquelle dar, auch wenn sie immer nur eine begrenzte Approximation der menschlichen Situation darstellen und aufgrund der Anzahl entscheidender Variablen (z. B. Dosis, Dosisrate, Beobachtungszeit, genetischer Risikohintergrund) sehr aufwändig und zeitraubend sind.
Im EU-Projekt CARDIORISK wurde der Effekt niedriger, moderater und hoher Strahlendosen nach lokaler Herzexposition von Mäusen untersucht. Im interessierenden Dosisbereich konnte zwar keine Beeinträchtigung der Herzfunktion beobachtet werden, aber es waren vier Wochen nach Exposition mit 200 mGy molekulare Veränderungen in den Herzmitochondrien nachweisbar. Es liegen jedoch noch keine weitergehenden Daten vor, die einen Schluss auf einen ursächlichen Zusammenhang dieser Veränderungen mit Herz-Kreislauferkrankungen nach Expositionen mit Dosen kleiner als 500 mGy erlauben.
Bisher gibt es nur eine experimentelle Arbeit, die kardiovaskuläre Effekte einer Ganzkörperexposition im hier interessierenden Dosisbereich analysiert. Im Rahmen des EU-Projekts NOTE wurden genetisch für Arteriosklerose prädisponierte ApoE-/-Mäuse mit Dosen von 25 mGy bis 500 mGy exponiert. Drei und sechs Monate später wurden arteriosklerotische Veränderungen der Aorta ascendens histologisch untersucht sowie eine ganze Palette von Entzündungsmarkern analysiert. Im Ergebnis ergab sich kein einheitliches Bild; auch eine Hemmung der Progression der Arteriosklerose konnte insbesondere für Dosisgruppen < 100 mGy nicht ausgeschlossen werden. Ein Vergleich unterschiedlicher Dosisleistungen zeigte teilweise gegenläufige Effekte, was darauf hinweist, dass möglicherweise mehrere biologische Mechanismen die Modulation der Erkrankungsprogression beeinflussen könnten.
Bei der Interpretation dieser Ergebnisse muss unbedingt berücksichtigt werden, dass bisher nur die Effekte einer einmaligen Exposition analysiert wurden. Die Effekte wiederholter Expositionen oder einer chronischen Exposition mit niedriger Dosisleistung müssen noch untersucht und die bisher vorliegenden Ergebnisse zwingend in einem alternativen Arteriosklerosemodell bestätigt werden.
5 Epidemiologische Studien des Strahlenrisikos
Aus einer zunehmenden Zahl strahlenepidemiologischer Studien liegen Daten zum Risiko kardiovaskulärer Erkrankungen in Abhängigkeit von Expositionen gegenüber ionisierender Strahlung im Bereich moderater und niedriger Dosen vor.
Die Daten der Atombombenüberlebenden von Hiroshima und Nagasaki (Life Span Study, LSS) bilden eine wesentliche Grundlage zur Risikobeurteilung kardiovaskulärer Erkrankungen nach Strahlenexposition mit moderaten Dosen. Daneben gewinnen epidemiologische Beobachtungen bei Majak-Arbeitern an Bedeutung. In beiden Kohorten wurden nicht nur Daten zur Strahlenexposition, sondern auch zu weiteren für kardiovaskuläre Erkrankungen bedeutsamen Risikofaktoren wie Rauchen, Alkoholkonsum oder Fettleibigkeit miterfasst. Weitere große Studien sind die Arbeiter bei British Nuclear Fuels (BNFL), der Personen, die im UK-Strahlenregister erfasst sind, der Tschernobyl-Aufräumarbeiter, der Wismut-Bergarbeiter und die 15 Länder-Studie von Arbeitern in der Nuklearindustrie.
Die Ergebnisse der einzelnen vorliegenden Studien längerfristiger Strahlenexpositionen können wenn überhaupt, dann nur mit Vorsicht verallgemeinert werden, da zum Beispiel eine Inhomogenität der Ergebnisse für Teilgruppen festgestellt wurde (BNFL-Arbeiter, Tschernobyl-Aufräumarbeiter) oder sich widersprüchliche Ergebnisse für Mortalität und Inzidenz ergaben (zerebrovaskuläre Erkrankungen unter den Majak-Arbeitern). Dennoch lassen sich aus der Gesamtheit der Studien Schlüsse auf Risiken von Herz-Kreislauferkrankungen nach Exposition mit moderaten Strahlendosen ziehen.
In ihrer Gesamtheit weisen die vorliegenden epidemiologischen Studien längerfristiger Expositionen mit moderaten Dosen von Niedrig-LET-Strahlung auf ein Risiko häufigerer Herz-Kreislauferkrankungen hin. Die Studien ergeben keinen Hinweis darauf, dass sich das Risiko von dem Risiko unter denjenigen Atombombenüberlebenden, die einer akuten Exposition mit der vergleichbaren Dosis ausgesetzt waren, unterscheidet. Allerdings bestehen nach wie vor große Unsicherheiten über die Höhe des Risikos.
Aus der Literatur stehen Auswertungen epidemiologischer Daten mit einer linearen Dosis-Wirkungsbeziehung zur Verfügung. Es ergaben sich für Herz-Kreislauferkrankungen Werte des zusätzlichen relativen Risikos (ERR) je Dosis in der Größenordnung von 0,1 Gy-1. Ähnliche Risikowerte wurden auch jeweils für die Untergruppen ischämische Herzerkrankungen und zerebrovaskuläre Erkrankungen abgeschätzt.
Es gibt widersprüchliche Evidenz bezüglich der Frage, ob die Dosis-Wirkungsbeziehung im Bereich von einigen hundert Milligray eine Schwelle hat oder ob das ERR in diesem Dosisbereich deutlich geringer ist, als es sich bei Verwendung einer linearen Dosis-Wirkungsbeziehung aus den vorliegenden epidemiologischen Studien ergibt. Eine Analyse der LSS-Daten mit der Multi-Modell-Methode ergab, dass das ERR für Herz-Kreislauferkrankungen bei 400 mGy um ca. einen Faktor 3 geringer ist als das Ergebnis der Analyse mit der linearen Dosis-Wirkungsbeziehung. Damit wäre das ERR für Herz-Kreislauferkrankungen bei 400 mGy um eine Größenordnung kleiner als das ERR für Krebs. Da die Spontanrisiken für Herz-Kreislauferkrankungen höher sind als für Krebserkrankungen, sind die Unterschiede der zusätzlichen absoluten Risiken geringer als die Unterschiede der zusätzlichen relativen Risiken.
6 Zusammenfassung und Bewertung
Weltweit gehören Herz-Kreislauferkrankungen zu den häufigsten Todesursachen. In Deutschland bildeten auch im Jahre 2008 die Herz-Kreislauferkrankungen mit 42 % aller Todesfälle die Hauptursachengruppe. Die hierbei führenden Todesursachen waren ischämische Herzerkrankungen und zerebrovaskuläre Erkrankungen.
Herz-Kreislauferkrankungen sind oft durch eine Arteriosklerose bedingt, die mit genetischer Prädisposition (z. B. Hyper cholesterinämie), Umweltfaktoren, Lebensstil-bedingten Faktoren (z. B. Rauchen) oder anderen Grunderkrankungen (metabolisches Syndrom, Diabetes oder Niereninsuffizienz) assoziiert ist. Neben der Verengung der zuführenden Arterien spielen für das klinische Erscheinungsbild der mangelnden Blutversorgung (Ischämie oder Infarkt) auch Struktur- und/oder Funktionseinschränkungen des versorgenden Kapillarnetzes der betroffenen Organe eine teilweise entscheidende Rolle.
Über die grundlegenden biologischen Wirkmechanismen von Strahlenexposition im niedrigen oder moderaten Dosisbereich auf die Pathogenese von Herz-Kreislauferkrankungen ist nur wenig bekannt. Trotz intensiver experimenteller Forschung ist der Ablauf an keinem Tiermodell exakt reproduzierbar. Zu Effekten auf die Arterioskleroseprogression im Tiermodell liegt lediglich eine experimentelle Arbeit vor. In dieser Studie sind alle untersuchten Dosis-Wirkungsbeziehungen nicht-linear und im Allgemeinen nach Exposition mit niedrigen Dosen und relativ niedriger Dosisleistung sowohl im frühen als auch späten Erkrankungsstadium protektiv. Im Gegensatz dazu wurden nach Exposition mit hoher Dosisleistung im frühen Erkrankungsstadium sowohl protektive als auch nachteilige Wirkungen beobachtet.
Eine zunehmende Zahl von epidemiologischen Studien weist auf ein Risiko häufigerer Herz-Kreislauferkrankungen nach Expositionen mit Niedrig-LET-Strahlung mit moderaten Dosen hin. Die Studien ergeben keinen Hinweis darauf, dass sich das Risiko von dem Risiko unter denjenigen Atombombenüberlebenden, die einer akuten Exposition mit der vergleichbaren Dosis ausgesetzt waren, unterscheidet. Allerdings bestehen nach wie vor große Unsicherheiten über die Höhe des Risikos.
Analysen der vorliegenden Studien mit einer linearen Dosis-Wirkungsbeziehung ergeben Werte des ERR je Dosis in einer Größenordnung von 0,1 Gy-1. Es gibt sowohl für akute wie für länger anhaltende Expositionen widersprüchliche Evidenz bezüglich der Frage, ob das ERR bei einigen hundert Milligray (mGy) deutlich geringer ist, als es sich bei Verwendung einer linearen Dosis-Wirkungsbeziehung aus den vorliegenden epidemiologischen Studien ergibt. Dies gilt auch für die Frage, ob es eine Schwelle im Bereich von einigen hundert Milligray gibt.
Nach wie vor bestehen große Unsicherheiten über mögliche Herz-Kreislaufrisiken nach Strahlenexpositionen mit einer Energiedosis von einigen hundert Milligray. Dennoch erlauben die obigen Betrachtungen einen ersten Vergleich der Mortalitätsrisiken für Herzkreislauf- und Krebserkrankungen nach einer Exposition, die dem Grenzwert für die Berufslebensdosis entspricht. Demnach sind absolute Risiken für Herz-Kreislauferkrankungen nach Strahlenexposition mit einer Dosis von einigen hundert Milligray zwar geringer, aber möglicherweise doch in der gleichen Größenordnung wie die entsprechenden Krebsrisiken. Allerdings kann auch eine Schwelle in der Dosis-Wirkungsbeziehung für Herz-Kreislauferkrankungen im Bereich von einigen hundert Milligray nicht ausgeschlossen werden.
Die Hinweise auf mögliche Risikoerhöhungen für Herz-Kreislauferkrankungen nach Strahlenexpositionen mit einer Dosis von einigen hundert Milligray sollten, obwohl ein Nullrisiko nicht ausgeschlossen werden kann, aus Vorsorgegründen und angesichts bestehender wissenschaftlicher Unsicherheiten bei der Erarbeitung gesetzlicher Regelungen berücksichtigt werden.
Es sind weitergehende epidemiologische, experimentell strahlenbiologische und mechanistisch modellierende Studien notwendig, um den Dosis-Wirkungsverlauf für Herz-Kreislauferkrankungen nach Strahlenexposition mit Dosen im Bereich niedriger und moderater Dosen abzuschätzen.
Herz-Kreislauferkrankungen nach zulässigen beruflichen Strahlenexpositionen
Wissenschaftliche Begründung der Stellungnahme der Strahlenschutzkommission
Inhaltsübersicht
1 Einleitung
2 Herz-Kreislauferkrankungen in Deutschland – deskriptive Epidemiologie
2.1 Einleitung
2.2 Bedeutung von Herz-Kreislauferkrankungen
2.3 Häufigkeit von Herz-Kreislauferkrankungen
2.3.1 Alle Herz-Kreislauferkrankungen
2.3.2 Ischämische Herzerkrankungen, koronare Herzkrankheit (KHK)
2.3.3 Zerebrovaskuläre Erkrankungen
2.4 Risikofaktoren von Herz-Kreislauferkrankungen
2.4.1 Rauchen
2.4.2 Übermäßiger Alkoholkonsum
2.4.3 Fettstoffwechselstörungen
2.4.4 Bluthochdruck (Hypertonie)
2.4.5 Diabetes mellitus
2.4.6 Übergewicht und Adipositas
2.4.7 Körperliche Inaktivität
2.4.8 Häufung kardiovaskulärer Risikofaktoren
2.4.9 Biomarker zur Abschätzung des kardiovaskulären Risikos
2.5 Literaturverzeichnis
3 Pathogenese von Herz-Kreislauferkrankungen
3.1 Einleitung
3.2 Informationsquellen zu potenziell strahleninduzierbaren kardiovaskulären Erkrankungen
3.2.1 Epidemiologie
3.2.2 Tierexperimentelle Modelle
3.2.3 In-vitro-Modelle
3.2.4 Theoretische strahlenbiologische Überlegungen
3.3 Pathogenese relevanter kardiovaskulärer Erkrankungen
3.3.1 Ischämische Herzerkrankung
3.3.2 Periphere Arteriosklerose
3.3.3 Störung der myokardialen Mikrozirkulation
3.3.4 Kombinierte Störungen der myokardialen Mikrozirkulation
3.4 Literaturverzeichnis
4 Mögliche Mechanismen des Einflusses von Strahlenexpositionen auf die Pathogenese von Herz-Kreislauferkrankungen
4.1 Einleitung
4.2 Hypothetische Mechanismen
4.2.1 Monoklonale Entstehung von arteriosklerotischen Plaques (Mutationstherorie)
4.2.2 Umwandlung glatter Muskelzellen aus ruhenden, kontraktilen SMC zu proliferierenden, sezernierenden SMC
4.2.3 Entzündungsreaktionen und Veränderungen in Mikrogefäßen (entzündlich/mikrovaskuläre Theorie)
4.3 Untersuchungen am Menschen
4.4 Tierexperimentelle Untersuchungen
4.4.1 Experimentelle Daten zur Strahlenwirkung hoher Strahlendosen
4.4.1.1 Arteriosklerose
4.4.1.2 Fokale Perfusionsstörungen am Myokard
4.4.1.3 Einschränkungen der Pumpfunktion des Herzens
4.4.1.4 Einschränkungen mikrovaskulärer Endothelzellfunktionen
4.4.2 Geeignete Tiermodelle für die Untersuchung von Strahlendosen < 1 Gy
4.4.3 Experimentelle Daten zur Strahlenwirkung von Strahlendosen < 1 Gy
4.5 In-vitro-Untersuchungen
4.6 Literaturverzeichnis
5 Epidemiologische Studien des Strahlenrisikos
5.1 Einleitung
5.2 Methodische Aspekte
5.2.1 Literaturrecherche
5.2.2 Endpunkte
5.2.3 Expositionen und Dosisbereiche im Überblick
5.2.4 Risikoschätzungen und der Healthy-Worker-Effekt
5.3 Epidemiologische Studien
5.3.1 Daten der Atombombenüberlebenden
5.3.2 Patienten – Therapie und Diagnostik
5.3.3 Beruflich exponierte Personen
5.3.3.1 Medizinisches Personal
5.3.3.2 Internationale Studie von Beschäftigten in der Nuklearindustrie
5.3.3.3 Strahlenexponierte Arbeiter in Großbritannien
5.3.3.4 Majak-Arbeiter
5.3.3.5 Uranbergarbeiter
5.3.4 Durch den Tschernobyl-Unfall exponierte Personen
5.3.5 Durch Atomwaffentests exponierte Personen
5.3.6 Reviews und Meta-Analysen
5.4 Limitationen der vorliegenden Studien
5.5 Zusammenfassung und Bewertung
5.5.1 Herz-Kreislauferkrankungen
5.5.2 Ischämische Herzerkrankungen
5.5.3 Zerebrovaskuläre Erkrankungen
5.5.4 Dosis-Wirkungsbeziehung unterhalb von 500 mGy
5.5.5 Risikoabschätzung für eine Exposition mit 400 mGy
5.6 Literaturverzeichnis
6 Evidenz eines Zusammenhangs von Herz-Kreislauferkrankungen mit vorangegangenen Expositionen ionisierender Strahlung mit einer Energiedosis von einigen hundert Milligray
Anhang
Abbildungsnachweis
Tabellennachweis
1 Einleitung
Diese wissenschaftliche Begründung gibt eine Zusammenfassung der wissenschaftlichen Grundlagen der SSK-Stellungnahme zu Herz-Kreislauferkrankungen nach Strahlenexpositionen, die dem Grenzwert der Berufslebensdosis nach § 56 der Strahlenschutzverordnung entsprechen. Der Begriff Herz-Kreislauferkrankungen umfasst hier ischämische Herzerkrankungen (Code 120-125 in Kapitel IX der International Statistical Classification of Diseases and Related Health Problems (ICD) der WHO, 10. Revision) und zerebrovaskuläre Krankheiten (Code 160-169).
Die vorliegende Stellungnahme bezieht sich ausschließlich auf Risiken von Herz-Kreislauferkrankungen nach Exposition mit Niedrig-LET-Strahlung (insbesondere Röntgen- und Gammastrahlung) im Bereich einiger hundert Milligray. Risiken durch Neutronenstrahlung oder durch inkorporierte Alphastrahler (z. B. Radon und seine Zerfallsprodukte) werden in der vorliegenden Stellungnahme nicht behandelt.
Die Risikobetrachtungen dieser Stellungnahme beruhen auf der Messgröße Energiedosis, die – anders als die im Strahlenschutz verwendete effektive Dosis – keine Wichtungsfaktoren für verschiedene Strahlenarten oder bestimmte Körperorgane enthält. Für die hier betrachtete Niedrig-LET-Strahlung sind die Zahlenwerte von zitierten effektiven Dosen für homogene Ganzkörperbestrahlungen oder von Organdosen identisch mit den entsprechenden mittleren Energiedosen.
Die Advisory Group on Ionising Radiation der Health Protection Association (AGIR) hat im Oktober 2010 einen ausführlichen Bericht zum Risiko von Herz-Kreislauferkrankungen nach Strahlenexposition veröffentlicht. Dieser Bericht ist eine zusätzliche Informationsquelle zu der vorliegenden wissenschaftlichen Begründung. Beide Berichte bewerten die vorliegenden Fakten in wesentlichen Punkten ähnlich. Die vorliegende wissenschaftliche Begründung berücksichtigt allerdings auch Arbeiten, die nach der Fertigstellung des AGIR-Berichtes veröffentlicht wurden.
Diese wissenschaftliche Begründung gliedert sich in die folgenden Kapitel:
- –
- Deskriptive Epidemiologie für Herz-Kreislauferkrankungen in Deutschland
- –
- Pathogenese von Herz-Kreislauferkrankungen
- –
- Mögliche Mechanismen des Einflusses von Strahlenexpositionen auf die Pathogenese von Herz-Kreislauferkrankungen
- –
- Epidemiologische Studien zu Herz-Kreislauferkrankungen nach Strahlenexpositionen mit niedrigen oder moderaten Dosen (Energiedosis < 1 Gy).
2 Herz-Kreislauferkrankungen in Deutschland – deskriptive Epidemiologie
2.1 Einleitung
Weltweit gehören Herz-Kreislauferkrankungen zu den häufigsten Todesursachen (WHO 2007). Innerhalb Deutschlands sind deutliche Unterschiede der Gesamtmortalität beim Vergleich der 16 deutschen Bundesländer zu erkennen. In Sachsen-Anhalt wurde 2008 mit 865,3 Todesfällen je 100 000 Einwohner die höchste, in Baden-Württemberg mit 689,6 Einwohnern die niedrigste Mortalität festgestellt. Diese Unterschiede sind hauptsächlich auf die Schwankungen der Mortalität durch Herz-Kreislauferkrankungen zurückzuführen. Die zugrunde liegenden Ursachen der regionalen Unterschiede bei der Herz-Kreislaufmortalität sind bisher nicht geklärt. Als mögliche Ursachen kommen vor allem „klassische“ Risikofaktoren, demografische, soziale, verhaltensbedingte und auch versorgungsmedizinische Faktoren in Frage, darüber hinaus spielen möglicherweise Umwelteinflüsse und genetische Faktoren eine Rolle. Auch könnten Unterschiede im Ausfüllen der Todesbescheinigungen bzw. in der Kodierung von Todesursachen von Bedeutung sein.
2.2 Bedeutung von Herz-Kreislauferkrankungen
In Deutschland verursachen Krankheiten des Kreislaufsystems etwa die Hälfte aller Krankenhausaufnahmen und Arbeitsunfähigkeitstage. Darüber hinaus bildeten auch im Jahre 2008 die Herz-Kreislauferkrankungen bei Männern und bei Frauen die Haupttodesursachengruppe in Deutschland; die führenden Todesursachen waren ischämische Herzerkrankungen und zerebrovaskuläre Erkrankungen (Todesursachenstatistik, Statistisches Bundesamt 2008).
Im Vergleich europäischer Staaten liegt Deutschland in Bezug auf die Mortalität bei der koronaren Herzkrankheit bzw. bei zerebrovaskulären Erkrankungen im mittleren Feld. Die osteuropäischen Staaten führen die Mortalitätsstatistik an, die mediterranen Länder zeigen die niedrigsten Mortalitätsraten (Levi et al. 2002).
In den meisten Ländern sind seit 1975 die Mortalitätsraten für kardiovaskuläre Erkrankungen um 24 % bis 28 % gesunken. Etwa 45 % dieses Rückganges sind auf eine verbesserte Therapie zurückzuführen, die restlichen 55 % werden einer Reduktion der kardiovaskulären Risikofaktoren zugeschrieben (Hennekens 2003). Auch in Deutschland zeigt sich seit vielen Jahren ein deutlicher Rückgang der Mortalitätsraten: zwischen 1980 und 2008 war bei den Frauen ein Rückgang von 803,9/100 000 Einwohner auf 345,6/100 000 Einwohner zu beobachten und bei den Männern ein Rückgang von 628,1/100 000 Einwohner auf 249,6/100 000 Einwohner (Standardbevölkerung „Deutschland 1987“; Statistisches Bundesamt). Die altersspezifische Mortalität hat ebenfalls abgenommen; jedoch wird durch den zunehmenden Anteil der älteren Bevölkerung die Anzahl der Personen mit Herz-Kreislauferkrankungen absolut gesehen ansteigen (Löwel und Meisinger 2006). Damit werden auch im 21. Jahrhundert Herz-Kreislauferkrankungen „die“ Erkrankungen bleiben, die das Erkrankungsspektrum und die Todesursachenstatistik anführen – sowohl in den Industrieländern als auch in den Entwicklungsländern (Murray et al. 1994).
2.3 Häufigkeit von Herz-Kreislauferkrankungen
Die Häufigkeit von Herz-Kreislauferkrankungen in einer Bevölkerung wird durch die Morbiditätsbegriffe Prävalenz und Inzidenz charakterisiert. Als Prävalenz bezeichnet man die Anzahl der Fälle einer bestimmten Krankheit in einer definierten Bevölkerung zu einem bestimmten Zeitpunkt. Die Inzidenz ist ein Maß für das Neuauftreten einer bestimmten Krankheit in einer bestimmten Bevölkerung während eines bestimmten Zeitraums (meist ein Jahr).
2.3.1 Alle Herz-Kreislauferkrankungen
Der Begriff Herz-Kreislauferkrankung erfasst im weitesten Sinne sämtliche Krankheiten des Herzens und des Blutkreislaufs; verwendet wird er aber in der Regel für verschiedene Teilmengen davon, wie vor allem ischämische Herzerkrankungen und zerebrovaskuläre Erkrankungen. Als Herz-Kreislauferkrankungen werden alle Erkrankungen bezeichnet, die im Kapitel IX der International Statistical Classification of Diseases and Related Health Problems (ICD) der WHO aufgelistet sind (Anhang Tabelle A1). Die epidemiologische Bedeutung der Herz-Kreislauferkrankungen ergibt sich primär aus ihrer Häufigkeit in der Todesursachenstatistik. Daten zur Mortalität nach ICD sind über die Todesursachenstatistik des Statistischen Bundesamtes verfügbar (Todesursachenstatistik, Statistisches Bundesamt 2008).
Obwohl in den letzten Jahren der Anteil der Herz-Kreislauferkankungen bei der Gesamtsterblichkeit zurückgegangen ist, bildeten auch im Jahre 2008 die Erkrankungen des Herz-Kreislaufsystems die Haupttodesursachengruppe in Deutschland; ihnen erlagen 356 729, d. h. fast jeder zweite Verstorbene der insgesamt 844 439 Todesfälle (42,2 %). Insgesamt 37,3 % der verstorbenen Männer und 46,6 % der verstorbenen Frauen starben an einer Herz-Kreislauferkrankung, wobei mehr als 90 % der Betroffenen 65 Jahre und älter waren. Laut Statistischem Bundesamt lag im Jahr 2008 die Herz-Kreislaufmortalität in Deutschland bei 434,4 je 100 000 Einwohner; im Vergleich dazu betrug im Jahr 1998 die Herz-Kreislaufmortalität 501,5 je 100 000 Einwohner (Statistisches Bundesamt 2008).
Im Zeitraum 1998 bis 2008 verringerte sich die Sterblichkeit an Herz-Kreislauferkrankungen bei Frauen und Männern in allen Altersgruppen; dabei war bei den Männern der Rückgang deutlicher ausgeprägt als bei den Frauen – vor allem in den höchsten Altersgruppen.
Die Sterblichkeit an Herz-Kreislauferkrankungen je 100 000 Einwohner im Jahr 2008 für Männer und Frauen in den verschiedenen Altersgruppen zeigt Abbildung 2.1 (Quelle: Todesursachenstatistik, Statistisches Bundesamt 2008). Sowohl bei Männern als auch bei Frauen nimmt die Sterblichkeit an Herz-Kreislauferkrankungen mit dem Alter zu. Je 100 000 Einwohner treten die meisten Herz-Kreislaufsterbefälle bei über 90-jährigen Männern und Frauen auf. Dabei ist die Sterblichkeit bei Männern in allen Altersgruppen höher als bei Frauen – außer in der Altersgruppe der über 90-Jährigen.
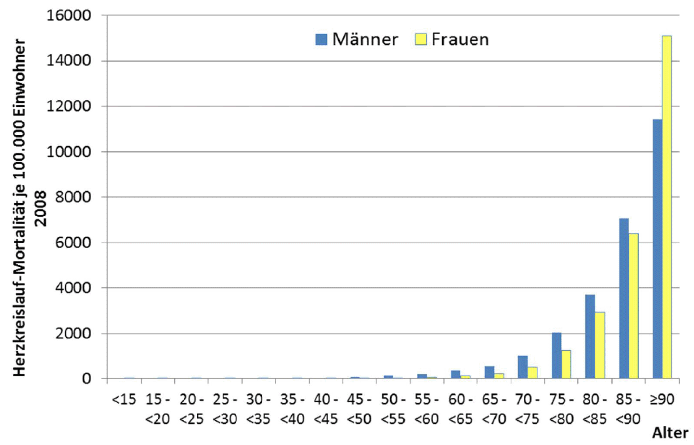
Abbildung 2.1: Alters- und geschlechtsspezifische Sterblichkeit an Herz-Kreislauferkrankungen je 100 000 Einwohner im Jahr 2008.
(Quelle: Todesursachenstatistik, Statistisches Bundesamt 2008)
Daten zur Prävalenz und Inzidenz für Herz-Kreislauferkrankungen insgesamt bzw. für einzelne Subgruppen liegen für Deutschland nicht vor. Über das Augsburger Herzinfarktregister bzw. das Ludwigshafener Schlaganfallregister werden bevölkerungsbasierte Daten erhoben, sodass bundesweite Schätzungen zur Inzidenz und Prävalenz für diese beiden Erkrankungen möglich sind.
2.3.2 Ischämische Herzerkrankungen, koronare Herzkrankheit (KHK)
Nach Angaben der World Health Organization (WHO) ist die koronare Herzkrankheit die häufigste Todesursache; im Jahr 2002 verstarben schätzungsweise 7,2 Millionen Personen weltweit an dieser Krankheit (WHO 2002). Laut Statistischem Bundesamt waren in Deutschland im Jahr 2008 ca. 17 % der Todesfälle bei den Männern bzw. 15 % der Todesfälle bei den Frauen auf eine ischämische Herzerkrankung zurückzuführen (Statistisches Bundesamt 2008). Zwar nehmen vor allem in den westlichen Industrieländern die Mortalitätsraten für die koronare Herzerkrankung ab (Hunink et al. 1997), jedoch gehen demografische Veränderungen mit einer höheren Lebenserwartung und damit mit einem verbesserten Überleben einher, sodass zukünftig viele Menschen erheblich länger mit der Erkrankung leben werden (Löwel und Meisinger 2006).
Als Komplikation einer ischämischen Herzkrankheit spielt der akute Myokardinfarkt eine vorrangige Rolle. Für Deutschland stehen seit dem Jahre 1985 über das bevölkerungsbasierte MONICA/KORA-Herzinfarktregister der Region Augsburg jährliche Daten zur Herzinfarktmorbidität – der häufigsten akuten lebensbedrohlichen Komplikation der KHK – je 100 000 Einwohner im Alter von 25 Jahren bis 74 Jahren zur Verfügung (www.gbe-bund.de).
Sowohl bei Männern als auch bei Frauen nimmt die Herzinfarkthäufigkeit mit dem Alter zu. Je 100 000 Einwohner treten die meisten Infarkte bei über 85-jährigen Männern und Frauen auf. Im Kalenderjahr 2008 ereigneten sich bei den etwa 42 Millionen weiblichen und 40 Millionen männlichen Einwohnern Deutschlands 249 000 (145 000 Männer, 104 000 Frauen) akute Koronarereignisse. Davon traten bei den Männern 2/3 der Herzinfarkte vor und bei den Frauen 2/3 der Herzinfarkte nach dem 75. Lebensjahr auf.
Wie die Daten des Augsburger Herzinfarktregisters zeigen, lag im Jahr 2008 die altersstandardisierte Herzinfarktinzidenz bei den 25- bis 74-jährigen Männern bei 248 je 100 000 Einwohner (95 %-KI: 227; 269) und bei den Frauen bei 84 je 100 000 Einwohner (95 %-KI: 72; 96).
Die altersspezifischen Lebenszeit-Prävalenzwerte steigen mit zunehmendem Alter bei beiden Geschlechtern an. Während das Infarktgeschehen bei 18- bis unter 30-jährigen Männern und Frauen praktisch keine Rolle spielt, nimmt im Altersbereich 30 Jahre bis 60 Jahre der Bestand an Postmyokardinfarktfällen bei den Männern um etwa das 3-fache zu. Der Prävalenzwert liegt bei den 70- bis 79-jährigen Männern bei 14,6 %. Bei den Frauen erreichen die Lebenszeit-Prävalenzen mit einer zeitlichen Verzögerung von ca. 10 Lebensjahren in etwa das Niveau der männlichen Prävalenzen (Wiesner et al. 1999a).
2.3.3 Zerebrovaskuläre Erkrankungen
Insgesamt 6 % der verstorbenen Männer und 9 % der verstorbenen Frauen starben im Jahr 2008 in Deutschland an einer zerebrovaskulären Erkrankung (Statistisches Bundesamt 2008). Der Schlaganfall ist die häufigste zerebrovaskuläre Erkrankung und die dritthäufigste Todesursache in Deutschland.
Anhand des Ludwigshafener Schlaganfallregisters ist es möglich, die Inzidenz klinisch manifester Schlaganfälle abzuschätzen. In den Jahren 2006 und 2007 lag die jährliche Anzahl von Neuerkrankungen je 100 000 Personenjahre (altersadjustiert auf die Europäische Population) bei insgesamt 146 (95 %-KI: 135; 157). Die altersadjustierte Inzidenzrate lag bei den Männern bei 163 Fällen je 100 000 (95 %-KI: 146; 181) und bei den Frauen bei 129 Fällen je 100 000 Personenjahre (95 %-KI: 115; 143) (Palm et al. 2010).
Besonders deutlich ist die Altersabhängigkeit des Schlaganfalls: die altersadjustierte Inzidenzrate stieg von 9 per 100 000 Personenjahre in der Altersgruppe 25 Jahre bis 34 Jahre auf 1 672 per 100 000 Personenjahre bei den über 85-Jährigen. In der Gruppe der über 65-Jährigen traten insgesamt mehr als 70 % aller Schlaganfälle auf (Palm et al. 2010).
Zuverlässige Angaben zur Prävalenz des Schlaganfalls aus sogenannten Primärdaten liegen für Deutschland nicht vor. Im Rahmen von bevölkerungsbezogenen Querschnittsstudien (Surveys) werden in der Regel nur die Schlaganfälle erfasst, die milder oder günstiger verlaufen sind. Trotz dieser eingeschränkten Erfassung liegt die aus den Daten des Bundesgesundheitssurveys 1998 (RKI 1998) für die deutsche Wohnbevölkerung im Alter von 30 Jahren bis 80 Jahren hochgerechnete absolute Anzahl von Personen nach Schlaganfall bei etwa 945 000.
Die Lebenszeit-Prävalenz (Krankenstand an Personen, die jemals im Laufe ihres Lebens einen Schlaganfall erlitten haben) in der Bevölkerung von 18 Jahren bis 79 Jahren beträgt insgesamt 1,55 % bei Männern und 1,73 % bei Frauen. Zwischen Männern und Frauen bestehen keine signifikanten Morbiditätsunterschiede; die Prävalenz liegt in der weiblichen Bevölkerung bei 1 730 je 100 000 der Wohnbevölkerung und in der männlichen Bevölkerung bei 1 530 je 100 000 Personen. Die altersspezifischen Prävalenzen steigen bei Frauen jenseits des 60. und bei Männern bereits jenseits des 50. Lebensjahres sprunghaft an. In der Altersgruppe der 70- bis 80-jährigen Männer und Frauen finden sich mit 8,4 % bzw. 7,5 % die höchsten Prävalenzwerte (Wiesner et al. 1999b).
2.4 Risikofaktoren von Herz-Kreislauferkrankungen
Nach einer orientierenden Einteilung (nach Grundy et al. 1999), die im Einzelfall im Lichte neuerer Forschungsergebnisse zu sehen ist, lassen sich kardiovaskuläre Risikofaktoren unterteilen in unabhängige Haupt-Risikofaktoren und weitere prädisponierende bzw. sonstige („conditional“) Risikofaktoren. Unter prädisponierenden Faktoren versteht man solche, die das Risiko bei Vorliegen der Haupt-Risikofaktoren verschlechtern. Sonstige Risikofaktoren sind solche, die mit einem erhöhten kardiovaskulären Risiko einhergehen, deren kausaler, unabhängiger und quantitativer Anteil jedoch nicht klar ist (Tabelle 2.1).
Tabelle 2.1: Orientierende Einteilung kardiovaskulärer Risikofaktoren (nach Grundy et al. 1999).
Haupt- | Prädisponierende Risikofaktoren | Sonstige Risikofaktoren |
Höheres Alter | Adipositas | Erhöhte Triglyzeride |
Männliches Geschlecht | Stammfettsucht | Kleine LDL- |
Bluthochdruck | Körperliche Inaktivität | Erhöhtes Homozystein |
Rauchen | Familiäre Belastung (z. B. Herzinfarkte bei erstgradig Verwandten) | Erhöhtes Lipoprotein (a) |
Diabetes mellitus | Ethnische Zugehörigkeit (z. B. südasiatische Herkunft) | Prothrombotische Faktoren, z. B. Fibrinogen |
Erniedrigtes HDL- Erhöhtes Gesamt- und LDL- | Psychosoziale Faktoren (z. B. soziale Isolation, Stress am Arbeitsplatz) | Entzündungsparameter, z. B. C- |
Hoher Alkoholkonsum |
Das männliche Geschlecht, eine positive Familienanamnese sowie das Lebensalter des Menschen sind nicht beeinflussbare Faktoren. Nach der Aufdeckung der Bedeutung einer familiären Veranlagung wurde in den letzten Jahren besonders die genetische Prädisposition weiter differenziert. Für verschiedene Genotypen konnte eine deutliche Assoziation mit einer Herz-Kreislauferkrankung gefunden werden (Nordlie et al. 2005). Von großem Interesse ist hierbei das Zusammenspiel zwischen genetischer Prädisposition und Umwelteinflüssen.
Für die Entstehung kardiovaskulärer Erkrankungen sind somit zahlreiche potenziell modifizierbare Risikofaktoren verantwortlich. Als „klassische Risikofaktoren“ kann man Rauchen, Hyperlipidämie, Hypertonie und Diabetes mellitus bezeichnen; weitere wichtige modifizierbare Risikofaktoren sind Übergewicht/Adipositas und körperliche Inaktivität. Auf diese Risikofaktoren wird nachfolgend näher eingegangen.
2.4.1 Rauchen
Tabakkonsum ist einer der größten vermeidbaren Risikofaktoren für Herz-Kreislauferkrankungen. Aus dem Gesundheitssurvey 2004 liegen aktuelle Daten zum Tabakkonsum in Deutschland vor (Lampert 2007). Auf Grundlage dieser Daten rauchen in Deutschland derzeit 36,5 % bzw. 27 % der über 17-jährigen Männer und Frauen. Mehr als 20 Zigaretten am Tag rauchen insgesamt 10,2 % der Männer und 4,7 % der Frauen und sind somit als „starke Raucher“ einzustufen. Die Prävalenz des Rauchens ist am höchsten im jungen Erwachsenenalter, ab dem 60. Lebensjahr geht die Prävalenz stark zurück. Unter Berücksichtigung früherer Gesundheitssurveys sind Trendaussagen zur Entwicklung des Tabakkonsums bei 25- bis 69-jährigen Männern und Frauen in den letzten 20 Jahren möglich: von Mitte der 80er Jahre bis zum Jahr 2004 hat der Anteil der männlichen Raucher von 41,6 % auf 37,4 % abgenommen, bei den Frauen war jedoch ein Anstieg von 26,7 % auf 29,6 % zu verzeichnen (Lampert 2007).
2.4.2 Übermäßiger Alkoholkonsum
Nach den Ergebnissen von Beobachtungsstudien ist moderater Alkoholkonsum nicht mit einem erhöhten, sondern mit einem geringeren kardiovaskulären Risiko assoziiert (Di Castelnuovo et al. 2002). In Deutschland wird unter einem moderaten Alkoholkonsum ein täglicher Alkoholkonsum für Männer bis 40 g und für Frauen bis 20 g angegeben. Liegt der tägliche Alkoholkonsum über diesen Mengen, so spricht man von einem hohen Alkoholkonsum (Singer 2002). Für die gefäßprotektive Wirkung eines moderaten Alkoholkonsums werden vor allem antioxidative Effekte, die Erhöhung des HDL-Cholesterins, antithrombotische und vasodilatierende Effekte diskutiert (Flesch et al. 1998). Wie Studien belegen, nimmt jedoch bei höherem Alkoholkonsum das Gesamtrisiko für Herz-Kreislauferkrankungen zu (Malyutina et al. 2002, Leon et al. 2009). Wie Daten aus Russland zeigen, haben Personen, die regelmäßig erhebliche Mengen Alkohol konsumieren, ein doppelt so hohes Risiko, an einer Herz-Kreislauferkrankung zu versterben
2.4.3 Fettstoffwechselstörungen
Die erhöhte Konzentration von Cholesterin und/oder Triglyzeriden ist ein wesentlicher Risikofaktor für Arteriosklerose und damit für Herz-Kreislauferkrankungen. Das Erkrankungsrisiko steigt mit zunehmenden Blutfett-Werten, insbesondere dem sogenannten LDL-Cholesterin, stetig an.
Unter Hypercholesterinämie versteht man eine deutliche Erhöhung des Gesamtcholesterins (zusammengesetzt aus dem LDL-Cholesterin und dem HDL-Cholesterin) im Blut. Die Risikobewertungsgrenze für Gesamtcholesterin wurde in den letzten Jahren deutlich nach unten korrigiert. Als anzustrebendes Ziel gilt derzeit ein Wert von unter 200 mg/100 ml. Wie Daten aus dem Bundesgesundheitssurvey 1998 (RKI 1998) zeigen, weisen bereits im Alter von 30 Jahren bis 39 Jahren 61,5 % der Frauen und 70,1 % der Männer einen Cholesterinwert von ≥ 200 mg/100 ml auf. Am häufigsten ist ein Gesamtcholesterinwert von ≥ 200 mg/100 ml bei 60- bis 69-jährigen Personen zu finden. In diesem Alter haben 86,9 % der Männer und 94,2 % der Frauen einen erhöhten Gesamtcholesterinwert (Thefeld 2000). Während jüngere Frauen gegenüber den Männern niedrigere Prävalenzen aufweisen, steigen diese nach der Menopause deutlich über die Prävalenzen der Männer.
2.4.4 Bluthochdruck (Hypertonie)
Bluthochdruck wird zu den wichtigsten Risikofaktoren für die Genese von Herz-Kreislauferkrankungen und einer reduzierten Lebenserwartung gezählt. Man spricht von Bluthochdruck, wenn der systolische Blutdruckwert in Ruhe ≥ 140 mmHg und/oder der diastolische Blutdruckwert ≥ 90 mmHg liegt.
Die Faktoren, die hohen Blutdruck begünstigen können, sind: familiäre Veranlagung, Übergewicht, falsche Ernährung, Nikotin, Alkohol, Bewegungsarmut, Stress. Im Bundesgesundheitssurvey 1998 (RKI 1998) hatte ein großer Anteil der 18- bis 79-jährigen Personen Blutdruckwerte von ≥ 140/90 mmHg (48 % der Männer, 39 % der Frauen). Die Prävalenz der arteriellen Hypertonie nimmt bei beiden Geschlechtern mit dem Alter kontinuierlich zu. In der Altersgruppe 70 Jahre bis 79 Jahre sind 72,9 % der Männer und 73,5 % der Frauen von einem Bluthochdruck betroffen (Thefeld 2000). Innerhalb Deutschlands zeigen sich deutliche Unterschiede in Bezug auf die Hypertonieprävalenz.
In einer aktuellen Studie konnte gezeigt werden, dass in Vorpommern und Süddeutschland die Prävalenz der arteriellen Hypertonie bei Männern höher ist als bei Frauen. Dabei sind die regionalen Prävalenzunterschiede bei den 25- bis 74-jährigen Männern mit durchschnittlich 60,1 % (95 %-KI: 57,9; 62,3) in Mecklenburg-Vorpommern und 41,4 % (95 %-KI: 39,1; 43,1) in Süddeutschland größer als bei den Frauen mit 38,5 % (95 %-KI: 36,6; 40,4) respektive 28,6 % (95 %-KI: 26,9; 30,3). Die Studie zeigte zudem, dass in beiden Regionen etwa 45 % der Männer und 30 % der Frauen nichts von ihren hohen Blutdruckwerten wussten (Meisinger et al. 2006).
2.4.5 Diabetes mellitus
In den vergangenen Jahren wurde deutlich, dass Patienten insbesondere mit diabetischer bzw. prädiabetischer Stoffwechsellage ein besonders hohes Risiko für arteriosklerotische Erkrankungen aufweisen (Hu et al. 2002; Isomaa et al. 2001). Darüber hinaus ist die Prognose für Diabetiker nach einem Herzinfarkt deutlich schlechter als für Personen ohne Diabetes. Aufgrund der Daten einer finnischen prospektiven Studie wurde angenommen, dass bei Diabetikern ohne erkennbare Herz-Kreislauferkrankungen das kardiovaskuläre Risiko ebenso hoch ist wie bei Nichtdiabetikern nach einem Herzinfarkt (Haffner et al. 1998). Nach den Daten des MONICA/KORA-Herzinfarktregisters Augsburg ist die Inzidenz des Myokardinfarktes bei Männern mit Diabetes mellitus 3,7-fach und bei diabetischen Frauen 5,9-fach erhöht im Vergleich zu Nichtdiabetikern (Löwel et al. 1999).
Aktuell ist von 5 bis 6 Millionen behandelten Diabetikern in Deutschland auszugehen. Jedoch nicht alle Menschen mit Diabetes sind diagnostiziert und in ärztlicher Behandlung. Im KORA S4 (1999 bis 2001) wurde erstmals die Diabeteshäufigkeit mittels oraler Glukosetoleranztests untersucht. KORA S4 ergab in der Altersgruppe 55 Jahre bis 74 Jahre eine Prävalenz des unentdeckten Diabetes von 8,2 %, die etwa so hoch war wie die Häufigkeit des bekannten Diabetes. Die Prävalenz des unentdeckten Diabetes mellitus war auch in der Altersgruppe 35 Jahre bis 59 Jahre mit 2,2 % etwa so hoch wie der diagnostizierte Diabetes (2,4 %), darüber hinaus fand sich bei 11 % ein Prädiabetes. In der KORA S4/F4-Kohortenstudie wurde das neue Auftreten eines Typ 2-Diabetes (Altersgruppe 55 Jahre bis 74 Jahre) erfasst. 10,5 % der Teilnehmer entwickelten innerhalb von 7 Jahren einen Typ 2-Diabetes, hierunter befanden sich etwa doppelt so viele Männer wie Frauen. Die altersgruppenspezifische Inzidenzrate (55 Jahre bis 74 Jahre) lag bei 1 550 pro 100 000 Personenjahre und betrug bei den 55- bis 74-jährigen Männern 2 020 pro 100 000 Personenjahre (Frauen: 1 130 pro 100 000 Personenjahre). Dies entspricht ca. 270 000 Neuerkrankungen pro Jahr (Rathmann et al. 2003, Rathmann et al. 2009, Meisinger et al. 2010).
2.4.6 Übergewicht und Adipositas
Um Übergewicht und Fettleibigkeit (Adipositas) voneinander abzugrenzen, klassifiziert man Personen mit einem Body Mass Index (BMI) von unter 25 kg/m2 als normalgewichtig, von 25 kg/m2 bis unter 30 kg/m2 als übergewichtig (präadipös) und von 30 kg/m2 oder höher als adipös (WHO 1997). In den letzten Jahrzehnten haben Übergewicht und Adipositas stark zugenommen und sich zu einer globalen Epidemie entwickelt. Bis zum Jahr 2015 wird mit einer Zunahme von Übergewicht und Adipositas um weitere 50 % gerechnet, sodass die Zahl übergewichtiger Menschen weltweit voraussichtlich auf mehr als 1,5 Milliarden ansteigen wird (WHO 1997). Auch in Deutschland hat in den letzten 20 Jahren der Anteil der übergewichtigen und adipösen Personen allmählich zugenommen (Mensink et al. 2005): in den Jahren 1998 und 2003 durchgeführte Bundesgesundheitssurveys ergaben eine Adipositasprävalenz von ca. 20 %.
Starkes Übergewicht geht mit einer hohen Prävalenz von Folgeerkrankungen und einer insgesamt erhöhten Mortalität einher (Hauner 1996). Bluthochdruck, ein wichtiger Hauptrisikofaktor für kardiovaskuläre Erkrankungen und damit auch für die Mortalität, ist eine der häufigsten Komplikationen bei Übergewicht. Studien belegen, dass eine arterielle Hypertonie bei Übergewichtigen etwa viermal häufiger als bei Normalgewichtigen vorkommt (Sharma et al. 1999).
Insgesamt sind etwa 22 % der 25- bis 74-jährigen Männer und 23 % der Frauen adipös, und etwa die Hälfte der Männer und ein Drittel der Frauen im selben Altersbereich haben Übergewicht. Für beide Geschlechter findet sich eine starke Zunahme von Übergewicht und Adipositas im Altersgang. Betrachtet man die Verbreitung von Übergewicht und Adipositas in den Altersgruppen, so findet sich bei Männern in allen Altersgruppen ein deutlich größerer Anteil von Übergewichtigen als bei Frauen (Meisinger et al. 2007). Wie Daten des Bundesgesundheitssurvey 1998 zeigen, sind im Alter von 20 Jahren bis 29 Jahren etwa 8 % der Männer und 9 % der Frauen adipös bzw. 42 % und 26 % übergewichtig. Bei den 60- bis 69-Jährigen beträgt die Prävalenz der Adipositas bei den Frauen etwa 35 % und bei den Männern etwa 28 %, Übergewicht war bei ca. 78 % der Frauen und 82 % der Männer in dieser Altersgruppe zu verzeichnen (Thefeld 2000).
2.4.7 Körperliche Inaktivität
Bewegungsarmut ist in verschiedenen Studien als Risikofaktor für die Entstehung von kardiovaskulären Erkrankungen sowie für eine erhöhte kardiovaskuläre Mortalität bestätigt worden. Körperliche Aktivität führt zu einer günstigen Beeinflussung aller klassischen kardiovaskulären Risikofaktoren und beeinflusst dadurch das Herz-Kreislaufsystem indirekt in positivem Sinne. Regelmäßige körperliche Aktivität beugt der Entwicklung eines Hypertonus vor, hat eine günstige Wirkung auf den Zuckerstoffwechsel, führt in Kombination mit einer fettarmen Diät zu einer Gewichtsreduktion und hat günstige Effekte auf den Cholesterinstoffwechsel (Lengfelder 2001).
Daten zur Verbreitung von Sport und körperlicher Aktivität in der deutschen Bevölkerung wurden im telefonischen Gesundheitssurvey von 2003 erhoben. Dabei wurden Fragen, die sich speziell auf Sportaktivitäten beziehen, berücksichtigt. Es zeigten sich deutliche Unterschiede nach Alter und Geschlecht. Bei den Männern sinkt die Teilnahme an regelmäßigem Sport von zwei und mehr Stunden pro Woche mit zunehmendem Alter kontinuierlich (von ca. 52 % in der Altersgruppe der 20- bis 29-Jährigen bis unter 30 % bei der Altersgruppe der 70- bis 79-Jährigen). Bei den Frauen ist der Anteil der Personen, die regelmäßig mehr als 2 Stunden pro Woche sportlich aktiv sind, durchgehend geringer: mit zunehmenden Alter sinkt dieser Anteil von ca. 40 % bei den 20- bis 29-Jährigen bis auf ca. 22 % der 70- bis 79-Jährigen (Telefonischer Gesundheitssurvey des RKI 2003).
2.4.8 Häufung kardiovaskulärer Risikofaktoren
Für die Entwicklung von kardiovaskulären Erkrankungen ist weniger der einzelne Risikofaktor relevant, sondern ihre Summe aus Alter, Geschlecht und den modifizierbaren Faktoren Fettstoffwechselstörung, Hypertonie, Adipositas, Rauchen und Bewegungsmangel. Die meisten Menschen, die kardiovaskuläre Erkrankungen erleiden, weisen verschiedene Risikofaktoren auf, die miteinander interagieren und zu einem Gesamtrisiko kumulieren (Keil et al. 2005).
Nach den Daten des Bundesgesundheitssurvey 1998 (RKI 1998) hat in etwa ein Drittel aller 18- bis 79-Jährigen keinen der Risikofaktoren tägliches Rauchen, Hypercholesterinämie (> 250 mg/100 ml), Adipositas (BMI ≥ 30 kg/m2) und Hypertonie (systolisch ≥ 160 mmHg und/oder diastolisch ≥ 100 mmHg). Etwa 40 % der Frauen und Männer weisen einen dieser Risikofaktoren auf, ca. 20 % zwei Faktoren und 5 % der Männer bzw. 6 % der Frauen haben drei Risikofaktoren gleichzeitig. Bei beiden Geschlechtern nimmt die Häufigkeit der Risikofaktoren mit steigendem Alter zu (Thefeld 2000).
2.4.9 Biomarker zur Abschätzung des kardiovaskulären Risikos
In den letzten Jahren wurden Biomarker, die mit einem erhöhten kardiovaskulären Risiko assoziiert sind, identifiziert. Ihre ursächliche Rolle und ihr unabhängiger und quantitativer Beitrag zur Pathogenese kardiovaskulärer Erkrankungen sind weniger gut belegt, als dies bei den klassischen Risikofaktoren der Fall ist. In einer Reihe von großen epidemiologischen Studien hat sich beispielsweise C-reaktives Protein (CRP), ein Inflammationsmarker, als unabhängiger Prädiktor für ein kardiovaskuläres Ereignis in gesunden Probanden und auch als Risikomarker nach einem akuten koronaren Ereignis erwiesen (Koenig et al. 1999; Ridker 2003). CRP stellt einen von mehreren neuen Inflammationsmarkern (z. B. Serum Amyloid A) dar, der unabhängig vom Lipidprofil mit künftigen kardiovaskulären Ereignissen verknüpft ist. Darüber hinaus wurden in Studien auch Lipid-assoziierte Marker, wie z. B. oxidiertes LDL (Ox LDL) und auch Hämostase/Thrombosemarker (z. B. Fibrinogen) als Risikomarker, die mit einem erhöhten kardiovaskulären Risiko assoziiert sind, gefunden. Schließlich gibt es eine ganze Reihe weiterer Marker mit starker Vorhersagekraft für die Entstehung von kardiovaskulären Erkrankungen (z. B. Homozystein, Cystatin C). Obschon diese Marker in prospektiven Studien mit einem erhöhten Risiko statistisch korrelieren, ist ihre Anwendung im Einzelfall in der Praxis noch umstritten (Pearson et al. 2003). Die verschiedenen Leitlinien empfehlen ihre routinemäßige Anwendung jedenfalls bislang nicht.
2.5 Literaturverzeichnis
Di Castelnuovo et al. 2002 | Di Castelnuovo A, Rotondo S, Iacoviello L, Donati MB, De Gaetano G. Meta- |
Flesch et al. 1998 | Flesch M, Erdmann E, Böhm M. Alkohol und Myokardinfarkt. Dtsch Med Wochenschr. 1998;123:1490 – 6 |
Grundy et al. 1999 | Grundy SM, Pasternak R, Greenland P, Smith S, Fuster V. Assessment of cardiovascular risk by use of multiple- |
Haffner et al. 1998 | Haffner SM, Lehto S, Ronnemaa T, Pyorala K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med. 1998;339:229 – 234 |
Hauner 1996 | Hauner H. Gesundheitsrisiken von Übergewicht und Gewichtszunahme. Dt Ärztebl. 1996;93: A- |
Hennekens 2003 | Hennekens CH. Primary prevention of cardiovascular disease and stroke. UpToDate. 2003; www.uptodate.com |
Hu et al. 2002 | Hu FB, Stampfer MJ, Haffner SM. Elevated risk of cardiovascular disease prior to clinical diagnosis of type 2 diabetes. Diabetes Care. 2002;25:1129 – 1134 |
Hunink et al. 1997 | Hunink MG, Goldman L, Tosteson AN, Mittleman MA, Goldman PA, Williams LW, Tsevat J, Weinstein MC. The recent decline in mortality from coronary heart disease, 1980 – 1990. The effect of secular trends in risk factors and treatment. JAMA. 1997;277:535 – 542 |
Isomaa et al. 2001 | Isomaa B, Almgren P, Tuomi T. Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care. 2001;24:683 – 589 |
Keil et al. 2005 | Keil U, Fitzgerald A, Gohlke H, Wellmann J, Hense HW. Risikoabschätzung tödlicher Herz- |
Koenig et al. 1999 | Koenig W, Sund M, Fröhlich M, Fischer HG, Löwel H, Döring A, Hutchinson WL, Pepys MB. C- |
Lampert 2007 | Lampert T. Epidemiologie des Rauchens in Deutschland. Public Health Forum 15. 2007; Heft 54; http:// |
Lengfelder 2001 | Lengfelder W. Körperliche Inaktivität: zu beeinflussender Risikofaktor in der primären Prävention? Med Klin. 2001:96:661 – 9 |
Levi et al. 2002 | Levi F, Lucchini F, Negri E, La Vecchia C. Trends in mortality from cardiovascular and cerebrovascular diseases in Europe and other areas of the world. Heart. 2002; 88:119 – 124 |
Leon et al 2009 | Leon DA, Shkolnikov VM, McKee M. Alcohol and Russian mortality: a continuing crisis. Addiction. 2009;104:1630 – 1636 |
Löwel und Meisinger 2006 | Löwel H, Meisinger C. Epidemiologie und demografische Entwicklung am Beispiel kardiovaskulärer Erkrankungen in Deutschland. Med Klein. 2006;101:804 – 11 |
Löwel et al. 1999 | Löwel H, Stieber J, Koenig W, Thorand B, Hörmann A, Gostomzyk J, Keil U. Das Diabetesbedingte Herzinfarktrisiko in einer süddeutschen Bevölkerung: Ergebnisse der MONICA- |
Malyutina et al. 2002 | Malyutina S, Bobak M, Kurilovitch S, Gafarov V, Simonova G, Nikitin Y, Marmot M. Relation between heavy and binge drinking and all- |
Meisinger et al. 2006 | Meisinger C, Heier M, Völzke H, Löwel H, Mitusch R, Hense HW, Lüdemann J. Regional disparities of hypertension prevalence and management within Germany. J Hypertens. 2006;24(2):293 – 9 |
Meisinger et al. 2007 | Meisinger C, Döring A, Greschik C, Heier M. Epidemiologie der Adipositas- |
Meisinger et al. 2010 | Meisinger C, Straßburger K, Heier M, et al (2009) Prevalence of undiagnosed diabetes and abnormal glucose tolerance in 35- |
Mensink et al. 2005 | Mensink GBM, Lampert T, Bergmann E. Übergewicht und Adipositas in Deutschland 1984- |
Murray et al. 1994 | Murray DM, Hannan PJ, Jacobs DR, McGovern PJ, Schmid L, Baker WL, Gray C. Assessing intervention effects in the Minnesota Heart Health Program. Am J Epidemiol. 1994; 139:91 – 103 |
Nordlie et al. 2005 | Nordlie MA, Wold LE, Kloner RA. Genetic contributors toward increased risk for ischemic heart disease. J Mol Cell Cardiol. 2005;39(4):667 – 679 |
Palm et al. 2010 | Palm F, Urbanek C, Rose S, Buggle F, Bode B, Hennerici MG, Schmieder K, Inselmann G, Reiter R, Fleischer R, Piplack KO, Safer A, Becher H, Grau AJ. Stroke incidence and survival in Ludwigshafen am Rhein, Germany. The Ludwigshafen Stroke Study (LuSSt). Stroke. 2010;41:1865 – 1870 |
Pearson et al. 2003 | Pearson TA, Mensah GA, Alexander RW, Anderson JL, Cannon RO 3rd, Criqui M, Fadl YY, Fortmann SP, Hong Y, Myers GL, Rifai N, Smith SC Jr, Taubert K, Tracy RP, Vinicor F; Centers for Disease Control and Prevention; American Heart Association. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: A statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107(3):499 – 511 |
Rathmann et al. 2003 | Rathmann W, Haastert B, Icks A, Löwel H, Meisinger C, Holle R, Giani G. High prevalence of undiagnosed diabetes mellitus in Southern Germany: Target populations for efficient screening. The KORA survey 2000. Diabetologia. 2003; 46: 182 – 189 |
Rathmann et al. 2009 | Rathmann W, Strassburger K, Heier M, Holle R, Thorand B, Giani G, Meisinger C. Incidence of Type 2 diabetes in the elderly German population and the effect of clinical and lifestyle risk factors: KORA S4/F4 cohort study. Diabet Med. 2009;26:1212 – 1219 |
Ridker 2003 | Ridker PM. Clinical application of C- |
RKI 1998 | Robert- |
RKI 2003 | Robert- |
Sharma et al. 1999 | Sharma AM, Moeller T, Engeli S. Hypertonie bei Adipositas: Epidemiologie, Pathophysiologie und Behandlungsansätze. Dtsch med Wschr. 1999;124:1337 – 1341 |
Singer 2002 | Singer MV, Teyssen S. Serie – Alkoholismus: Moderater Alkoholkonsum – Gesundheitsförderlich oder schädlich. Dtsch Arztebl. 2002;99(16): A–1103 |
Statistisches Bundesamt 2008 | Statistisches Bundesamt. Todesursachenstatistik. Statistisches Bundesamt. 2008 (www.gbe- |
Thefeld 2000 | Thefeld W. Verbreitung der Herz- |
WHO 1997 | WHO Consultation on Obesity. Preventing and managing the global epidemic. Geneva, World Health Organization. 1997;1 – 276 |
WHO 2002 | The World Health Report 2002: Reducing risks, promoting healthy life. Geneva. 2002 |
WHO 2007 | World Health Organization. Prevention of cardiovascular disease. Guidelines for assessment and management of cardiovascular risk. Geneva. 2007 |
Wiesner et al. 1999a | Wiesner G, Grimm J, Bittner E. Zum Herzinfarktgeschehen in der Bundesrepublik Deutschland: Prävalenz, Inzidenz, Trend, Ost- |
Wiesner et al. 1999b | Wiesner G, Grimm J, Bittner E. Schlaganfall: Prävalenz, Inzidenz, Trend, Ost- |
3 Pathogenese von Herz-Kreislauferkrankungen
3.1 Einleitung
Aus der Vielzahl der Herz-Kreislauferkrankungen werden hier nur diejenigen betrachtet, für die es experimentelle, klinische oder epidemiologische Hinweise auf eine Assoziation mit Strahlenexposition im Allgemeinen, d. h. einschließlich Dosen > 2 Gy gibt. Dies sind einerseits die Arteriosklerose und andererseits Störungen der mikrovaskulären Perfusion. Solange nicht abschließend klar ist, welche klinischen Diagnosen konkret mit Expositionen < 2 Gy in Zusammenhang stehen, stellen sich bei Beantwortung von Fragen nach deren Pathogenese und insbesondere nach Dosis-Wirkungsbeziehungen methodische Probleme.
Im Folgenden werden zunächst Informationsquellen genannt, die zur Ableitung von Hypothesen hinsichtlich der für die kardiovaskulären Strahlenwirkungen relevanten Diagnosen geeignet sind (Abschnitt 3.2). Anschließend werden die Pathogenesen der Arteriosklerose und der mikrovaskulären Perfusionsstörungen skizziert (Abschnitt 3.3).
3.2 Informationsquellen zu potenziell strahleninduzierbaren kardiovaskulären Erkrankungen
3.2.1 Epidemiologie
Eine wichtige Quelle zur Aufstellung von Hypothesen über die Strahlenwirkung sind epidemiologische Daten, die für einzelne Diagnosen eine statistische Assoziation mit Strahlenexposition aufweisen. Diese Daten sind der Ausgangspunkt des aktuellen Interesses an kardiovaskulären Strahlenwirkungen und werden an anderer Stelle ausführlich referiert (Kapitel 5). Hinsichtlich der präzisen Bestimmung relevanter klinischer Diagnosen oder hinsichtlich pathogenetischer Aspekte geben die epidemiologischen Daten jedoch nur bedingt Auskunft: Sie basieren häufig auf Todesursachenstatistiken, d. h. auf Todesscheinen, die in Bezug auf Diagnosen oft ungenau sind. Inzidenzdaten sind grundsätzlich besser geeignet als Todesursachenstatistiken, um zur Frage der Assoziation von Strahlenexposition und kardiovaskulären Erkrankungen beizutragen. In jedem Fall sind jedoch Diagnosen wie „Herztod“, ebenso wie „Herzinfarkt“, „koronare Herzerkrankung“, „Schlaganfall“ oder „periphere Arteriosklerose“ in der allgemeinen Bevölkerung häufig, sind bekanntermaßen multifaktoriell bedingt und in ihrem Erscheinungsbild in Bezug auf den individuellen Entstehungsmechanismus unspezifisch. Im Einzelfall ist es daher meist nicht möglich, einen Zusammenhang zu einer vorausgegangenen Exposition herzustellen. Nur in wenigen Fällen, in denen arteriosklerotische Läsionen isoliert an atypischen Gefäßabschnitten auftreten, die dem Bestrahlungsvolumen einer vorangegangenen Strahlentherapie eindeutig zuzuordnen sind, kann ein Zusammenhang auch im Einzelfall zumindest vermutet werden. Konkretes Beispiel sind arteriosklerotische Veränderungen der Arteria mammaria interna, die völlig geradlinig verläuft und keine „spontane“ Arteriosklerose zeigt, nach Strahlenbehandlung von Brustkrebs (Russel 2009).
3.2.2 Tierexperimentelle Modelle
Im Tierexperiment können entweder durch gezielte Interventionen und/oder genetische Manipulationen klinisch relevante Krankheitsbilder nachgestellt und dann detailliert in ihrer Entstehung analysiert werden. Sofern konkrete Hypothesen hinsichtlich relevanter Erkrankungen oder Wirkungsweisen vorliegen, stellen Tiermodelle das wichtigste verfügbare Instrument zur Analyse der Pathogenese, der Dosis-Wirkungsbeziehungen von einzelnen Mechanismen, der Volumen-Wirkungsbeziehungen und der Interaktion mit anderen Faktoren oder Vorerkrankungen dar. Eine Vielzahl von gut charakterisierten experimentellen Tiermodellen sowie die in den letzten Jahren rasant angewachsenen Möglichkeiten der funktionellen, bildgebenden, histopathologischen oder molekularbiologischen Analysemethoden eröffnen hier vielfältige und vielversprechende Ansätze (siehe Kapitel 4). Jedoch ist trotz intensiver experimenteller Forschung der Ablauf der Herz-Kreislauferkrankungen im Menschen an keinem Tiermodell exakt reproduzierbar.
3.2.3 In-vitro-Modelle
Einfache Zellkulturmodelle haben sich aufgrund des Proliferationsverhaltens von Zellen in vitro als sehr nützliche Modelle für schnell wachsende, bösartige Tumoren erwiesen. Strahlenwirkungen auf Normalgewebe, die in vivo einen sehr geringen Zellumsatz zeigen und bei denen Strahlenfolgen erst im Laufe von Jahrzehnten klinisch symptomatisch werden, können dagegen unmöglich in einfachen Mono-Kultursystemen simuliert und verstanden werden. Selbst dann, wenn eine konkrete Hypothese bezüglich einzelner molekularer Wechselwirkungen analysiert werden soll, ist davon auszugehen, dass sich mit der Steigerung des Zellumsatzes auf ein etwa 100-faches des Physiologischen das gesamte phänotypische Programm der differenzierten Zellen verändert. Auch komplexe Ko-Kulturmodelle, die z. B. kapilläre Endothelzellen in Differenzierung und Teilungsruhe versetzen sollen, sind nur im Kontext ganz spezifischer experimenteller Hypothesen aussagekräftig. Eine ausführliche Diskussion verfügbarer Zellkulturmodelle findet sich in dem Bericht der UK Health Protection Agency „Circulatory Disease Risk“ aus 2010 (HPA 2010).
3.2.4 Theoretische strahlenbiologische Überlegungen
Die umfassenden experimentellen und theoretischen Erkenntnisse zum Zusammenhang von Krebserkrankungen und biologischen Wirkungen von Expositionen mit ionisierender Strahlung lassen sich nicht ohne Weiteres auf Herz-Kreislauferkrankungen übertragen. Grundsätzliche strahlenbiologische Überlegungen auf der Basis bestätigten „Lehrbuchwissens“ (zusammengefasst von Stewart und Dörr 2009) besagen, dass
- –
- für die Expression eines Strahlenschadens in erster Linie teilungsaktive Zellen verantwortlich sind,
- –
- der Zeitpunkt der Manifestation einer geweblichen Strahlenwirkung von der Umsatzzeit des Gewebes abhängt.
Trotz der geringen Teilungsaktivität von Endothelzellen stellen doch die kapillären Endothelzellen die quantitativ größte teilungsaktive Zellpopulation des Herzens dar. Dementsprechend wurde die Hypothese abgeleitet, dass sie die wahrscheinlichste Zielpopulation der Strahlenwirkung am Herz darstellen. Für Strahlendosen im therapeutischen Dosisbereich konnte diese Hypothese in zahlreichen Untersuchungen experimentell bestätigt und klinisch durch Beobachtung von regionalen, feldassoziierten myokardialen Perfusionsstörungen gestützt werden.
In Bezug auf das periphere Gefäßsystem lässt sich aus den genannten strahlenbiologischen Grundsätzen keine so klare Hypothese ableiten, weil beispielsweise die glatten Muskelzellen der Gefäßmedia nicht wie die Herzmuskelzellen ihre Fähigkeit zur Zellteilung verloren haben.
3.3 Pathogenese relevanter kardiovaskulärer Erkrankungen
3.3.1 Ischämische Herzerkrankung
Die Pathogenese der koronaren Herzerkrankung ist – da sie unmittelbar lebensbedrohlich sein kann – die am besten untersuchte und beschriebene arteriosklerotische Gefäßerkrankung. Da die wesentlichen Risikofaktoren und Mechanismen der Auslösung ebenso wie die Schritte der Entstehung bei der peripheren Arteriosklerose grundsätzlich ähnlich sind, sei die koronare Herzerkrankung hier exemplarisch im Detail dargestellt.
Früh schon wurden arteriosklerotische Plaques als Ursache ischämischer Herz-Kreislauferkrankungen erkannt. In den letzten Jahrzehnten wurden deren zelluläre und molekulare Entstehungsmechanismen weltweit intensiv beforscht. Im Ergebnis konnten zwar eine Reihe von pharmakologischen Interventionsmöglichkeiten etabliert werden, von denen jedoch keine einen abschließend befriedigenden und effizienten Therapieansatz darstellt (Thomas 2011), der eine drastische Senkung von Morbidität und Mortalität erwarten ließe.
In jüngerer Vergangenheit ermöglichten nichtinvasive, hochauflösende bildgebende Verfahren erstmals individuelle klinische Verlaufsstudien. Diese zeigen, dass arteriosklerotische Plaques ein stabiles Stadium erreichen können, in dem sie viele Jahre lang symptomlos bleiben. Die Pathogenese eines Herzinfarkts oder Schlaganfalls wird daher heute in zwei Phasen unterteilt:
A Entstehung einer arteriosklerotischen Läsion
B Destabilisierung und Ruptur der Läsion, die zur Thrombose und zum Gefäßverschluss bzw. klinisch zum Infarkt führen kann.
Im Folgenden werden Plaqueentstehung, Infarktauslösung und ein eventueller Beitrag mikrovaskulärer Gefäßerkrankungen im Hinblick auf mögliche Interaktionen mit einer Strahlenexposition beleuchtet.
A Entstehung einer arteriosklerotischen Läsion
Sowohl genetisch disponierende Faktoren (z. B. Hypercholesterinämie) als auch Umweltfaktoren, Lebensstil-bedingte Faktoren (z. B. Rauchen oder metabolisches Syndrom) als auch andere Grunderkrankungen (Diabetes, Niereninsuffizienz) gehören zu den Risikofaktoren, die mit der Arteriosklerose assoziiert sind.
Klinische und histopathologische Endpunkte der Arteriosklerose sind mit Ausnahme der Niereninsuffizienz, die spezifische Besonderheiten im Zeitablauf und der Pathogenese der in vielen Fällen resultierenden Arteriosklerose aufweist (Amann et al. 2003), weitgehend unabhängig von den individuellen Auslösern der Erkrankung.
Der Diabetes ist insofern eine weitere Ausnahme, als er mit einer kombinierten kardiovaskulären Erkrankung assoziiert ist (siehe unten).
Die wissenschaftliche Originalliteratur zur Entstehungsgeschichte arteriosklerotischer Läsionen ist fast unübersehbar: Unter den Stichworten „arteriosclerosis pathogenesis“ finden sich 57 487 Einträge. Die folgende Zusammenfassung beruht deshalb wesentlich auf jüngeren Übersichtsarbeiten (Bui et al. 2009, Hansson 2005, Libby 2002, Libby et al. 2011, Lusis 2000).
Die normale arterielle Gefäßwand ist dreischichtig aufgebaut (Abbildung 3.1a aus Libby et al. 2011). Die innerste Schicht, tunica intima, besteht aus dem Endothel, das einerseits mit dem Blut in Kontakt ist und andererseits einer Basalmembran aufliegt. Die Intima des Menschen enthält – im Gegensatz zu der von den üblichen Labortieren – auch glatte Muskelzellen. Nach außen schließt sich die tunica media an, die bei den muskulären Arterien des Menschen, die in erster Linie von der Arteriosklerose betroffen sind, aus einem Bindegewebsgeflecht und glatten Muskelzellen besteht. Die äußere Schicht, die Adventitia, enthält Mastzellen, Nervenenden und versorgende Kapillaren.
Bei der Initiierung arteriosklerotischer Gefäßveränderungen spielen lokale Scherkräfte (parallel zum Endothel wirkende Kräfte, wie sie an Verzweigungsstellen durch Turbulenzen des Blutflusses ausgelöst werden), eine wichtige auslösende, proinflammatorische Rolle. Sie sind für das typische Verteilungsmuster arteriosklerotischer Gefäßveränderungen im Bereich von Gefäßverzweigungen oder anderen Gefäßabschnitten mit erhöhter Turbulenz verantwortlich. Erhöhte Scherkräfte allein können bereits proinflammatorische Signalketten in Endothelzellen auslösen (Orr et al. 2005). Die initiale Induktion proinflammatorischer Signale ist von einer NFkappa-B-Induktion angeführt (Monaco et al. 2004). NFkappa-B (nuclear factor regulating expression of kappa light-chain immunoglobulin) ist ein Transkriptionsfaktor, der eine zentrale Rolle in der angeborenen Immunabwehr spielt und die Transkription einer Vielzahl proinflammatorischer Signalstoffe auslöst. Sobald lokal eine entzündliche Aktivierung von Endothelzellen vorliegt und gleichzeitig atherogene systemische Voraussetzungen gegeben sind, wird eine von der Interaktion von zirkulierendem LDL mit entzündlichen Signalkaskaden getragene Plaqueentwicklung in Gang gesetzt (Abbildung 3.1b bis 3.1c):
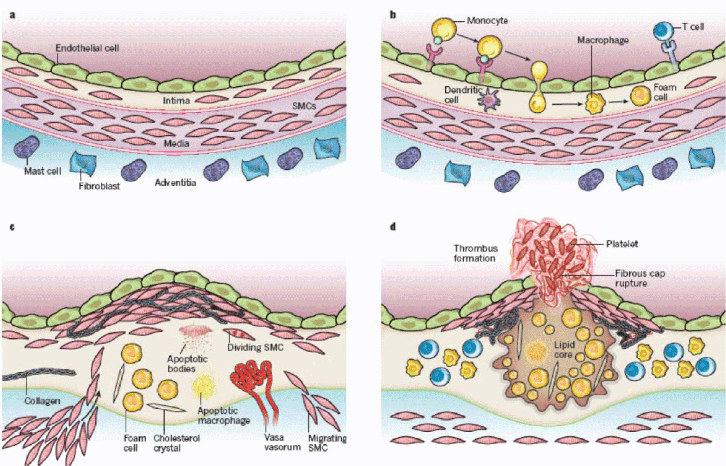
Abbildung 3.1: Schematische Darstellung der gesunden Wand einer menschlichen muskulären Arterie (a), der schrittweisen Entstehung einer arteriosklerotischen Läsion (b und c, Erläuterung siehe unten) sowie der Läsionsruptur und Thrombusbildung (d).
Die Verwendung der Abbildung erfolgte mit freundlicher Genehmigung von Macmillan Publishers LTD: Peter Libby et al.: Progress and challenges in translating the biology of atherosclerosis. Nature 473, 317-325, 19 May 2011, doi:10.1038/nature10146, Published online, 18 May 2011 http://
Es kommt zur Adhäsion und Einwanderung von Leukozyten in die Intima. In die Intima migrierte Monozyten differenzieren zu aktivierten Makrophagen, die Lipide aufnehmen und sich in Schaumzellen, dem histologischen Erkennungszeichen früher arteriosklerotischer Läsionen verwandeln (Abbildung 3.1b). Dabei wird eine Vielzahl von entzündlichen Signalstoffen in der Intima freigesetzt. Im nächsten Schritt (Abbildung 3.1c) wandern glatte Muskelzellen aus der Media in die Intima ein, proliferieren und gehen vom ruhenden, kontraktilen zum proliferierenden, sezernierenden Phänotyp über. Es bildet sich somit ein Läsionskern, der unter anderem durch Entzündungszellen und Schaumzellen charakterisiert ist, aber gegenüber dem Gefäßlumen durch eine Schicht von Glattmuskelzellen und eine fibröse Kappe abgeschlossen ist. In diesem Stadium kann die Läsion über viele Jahre hinweg stabil persistieren.
B Destabilisierung und Ruptur der Läsion, Gefäßverschluss durch Thrombose
Die Beobachtung langfristig stabiler und symptomloser arteriosklerotischer Plaques lenkte das Augenmerk in den letzten Jahren vermehrt auf die Mechanismen der Destabilisierung solcher Plaques und die eigentliche Infarktauslösung.
Für die Stabilität der Läsion spielen extrazelluläre Matrixmoleküle (wie zum Beispiel Kollagen, Elastin, Proteoglykane und Glykoproteine), die von den aktivierten Glattmuskelzellen sezerniert werden, eine wichtige Rolle (Finn et al. 2010). Wenn die fibröse Deckschicht des arteriosklerotischen Plaques jedoch dünner wird (< 65 μm) und keine glatten Muskelzellen mehr enthält (Burke et al. 1997, Virmani et al. 2006a), besteht die Gefahr von Einrissen oder Rupturen der fibrösen Deckschicht (Abbildung 3.1d).
Weitere morphologische Zeichen der Plaque-Instabilität sind ein großer nekrotischer Läsionskern, zunehmende Entzündungszeichen, eine messbare Veränderung der geometrischen Proportionen der Gefäßwand („vascular remodelling“), eine zunehmende Gefäßneubildung in den kleinen versorgenden Arterien der Gefäßwand (Vasa vasorum) und Einblutungen in die Läsion (Moreno 2010). Der Übergang zum instabilen Plaque erhöht das Risiko eines akuten Gefäßverschlusses (Moreno 2010). Bei Patienten, die eine klinisch symptomlose proximale Koronararterienstenose aufweisen, beträgt die jährliche Inzidenz eines klinischen Gefäßverschlusses 4 % bis 13 % (Moreno 2010). Kommt es zum Einriss oder zur Ruptur der fibrösen Deckschicht, geraten Kollagen, Lipide und Entzündungsfaktoren mit dem Blut in Kontakt, und es bildet sich ein Thrombus (Abbildung 3.1d). Der Thrombus kann sowohl an Ort und Stelle zum Verschluss führen als auch nach Abriss einen Verschluss weiter peripher gelegener Gefäßabschnitte verursachen.
3.3.2 Periphere Arteriosklerose
Die Arteriosklerose ist als generalisierte Erkrankung der Intima mittlerer und großer Arterien zu betrachten, da ein Großteil der auslösenden Faktoren systemisch ist. Zu klinisch relevanten Gefäßstenosen oder -verschlüssen kommt es aber in aller Regel an bestimmten Prädilektionsorten des Gefäßbaums, an denen als lokaler auslösender Faktor eine gesteigerte Scherkraft hinzukommt (Harloff et al. 2010). Besonders im Bereich von Bifurkationen entstehen turbulente Blutflüsse, die der Ausgangspunkt von Endothelveränderungen und – im Zusammenhang mit systemischen Faktoren – von arteriosklerotischen Läsionen sein können. Neben den Koronararterien ist die Karotisbifurkation eine besonders häufige und aufgrund der klinischen Konsequenzen (Schlaganfall) eines Verschlusses besonders kritische Lokalisation.
Auch die Aorta ist häufig von „spontanen“ arteriosklerotischen Veränderungen betroffen, interessanterweise jedoch nicht im Bereich des Aortenbogens der aufsteigenden intrathorakalen Aorta (Aorta ascendens [Liu et al. 2009]), sondern im Bereich der Bifurkation der Bauchaorta (Aorta abdominalis). Obwohl die Risikofaktoren mit denen für die Arteriosklerose übereinstimmen, scheint nicht nur die Morphologie, sondern auch die Entstehungsgeschichte dieser Läsionen eine andere zu sein (Nordon et al. 2009). Wandaufbau und Funktion der verschiedenen Abschnitte des peripheren Gefäßsystems unterscheiden sich ganz erheblich. Dennoch entsprechen die wichtigsten Entstehungsschritte der arteriosklerotischen Läsion der Halsschlagader (Arteria carotis) dem für die koronare Herzerkrankung beschriebenen Prozess (Virmani et al. 2006b).
3.3.3 Störung der myokardialen Mikrozirkulation
Ein weiterer Aspekt, der erst mit Hilfe von bildgebenden Techniken zur Darstellung der Myokardperfusion zum Forschungsgegenstand wurde, ist die Störung der Mikrozirkulation, die häufig parallel zu makrovaskulären Herz-Kreislauferkrankungen auftritt. Die Interaktion und relative Krankheitswertigkeit mikro- und makrovaskulärer Zirkulationsstörungen kann noch nicht abschließend eingeschätzt werden.
Grundsätzlich kann eine gestörte Kapillarperfusion zusätzlich oder auch unabhängig von einer verminderten Blutversorgung über die zuführenden Koronararterien zu einer Minderversorgung und Gewebeschädigung des Myokards führen.
Im gesunden Herzen verfügt das Kapillarnetz über eine hohe strukturelle und funktionelle Reserve, indem sich die jeweils von einer Kapillare versorgten Gewebegebiete überlappen. Die funktionelle Reservekapazität, definiert als Quotient der maximalen myokardialen Perfusion in Relation zur Perfusion in Ruhe, beträgt bei Gesunden ungefähr vier. Bei ischämischer, inflammatorischer oder dilatativer Kardiomyopathie und ebenso bei arteriellem Bluthochdruck (Hypertonie) ist dies jedoch nicht der Fall: sowohl strukturell – gemessen als Reduktion der Kapillardichte – als auch funktionell – gemessen mit der Positronenemissionstomographie oder der Dopplersonographie – zeigt sich die Mikrozirkulation des Myokards deutlich gestört (Karch et al. 2005).
Patientenstudien zeigen, dass das Ausmaß der vorliegenden Perfusionsstörungen ein Indikator des individuellen kardiovaskulären Risikos ist (Rizzoni et al. 2003). Bei Patienten mit arteriellem Bluthochdruck, die trotz unauffälliger Koronarangiographie unter Angina pectoris leiden, ist eine Verminderung der koronaren Durchblutungsreserve mit einer deutlich höheren Mortalität assoziiert (Marks et al. 2004).
Strukturelle oder funktionelle Störungen der myokardialen Mikrozirkulation sind demnach häufig. Sie können die Symptomatik einer vorhandenen koronaren Herzkrankheit verschlimmern und sind auch in Abwesenheit von arteriosklerotischen Veränderungen der Koronararterien mit Symptomen der ischämischen Herzerkrankung assoziiert.
3.3.4 Kombinierte Störungen der myokardialen Mikrozirkulation
Als besonders häufiges Beispiel für eine komplexe Kardiomyopathie, an der verschiedene Gewebekomponenten des Herzens beteiligt sind, sei die Diabetische Kardiomyopathie exemplarisch vorgestellt. Diabetes und metabolisches Syndrom sind wichtige Risikofaktoren für die Entstehung einer koronaren Herzerkrankung. Seit den frühen 70er Jahren ist jedoch bekannt, dass Diabetes darüber hinaus mit einer funktionell und strukturell nachweisbaren Kardiomyopathie assoziiert ist (Fein 1990), die unabhängig von arteriosklerotischen Veränderungen der Koronararterien mit einer Prävalenz von 60 % bei Typ-II Diabetikern auftritt (Di Bonito et al. 2005).
Es kommt dabei einerseits zu strukturellen Veränderungen mit interstitieller und perivaskulärer Fibrose, Zunahme von Kollagen Typ III, nicht aber von Typ I oder Typ IV (Shimizu et al. 1993), Verringerung der Kapillardichte sowie vermehrter Nekrose und Apoptose (Frustaci et al. 2000) von Kardiomyozyten (Aneja et al. 2008). Ultrastrukturell zeigen die Kardiomyozyten eine Reduktion der mitochondrialen Christae (Dhalla et al. 1998, Bugger und Abel 2008) Die funktionelle Reserve des Koronarsystems ist auch ohne obstruktive Erkrankung der Koronararterien reduziert.
Der pathogenetische Mechanismus der diabetischen Kardiomyopathie ist bei Weitem nicht aufgeklärt. Die Glukosekonzentration im Blut scheint eine unmittelbare Rolle zu spielen.
3.4 Literaturverzeichnis
Aneja et al. 2008 | Aneja A, Tang WHW, Bansilal S, Garcia MJ, Farkough ME. Diabetic cardiomyopathy: insights into pathogenesis, diagnostic challenges, and therapeutic options. Am J Med. 2008; 121:748 – 757 |
Amann et al. 2003 | Amann K, Tyralla K, Gross ML, Eifert T, Adamczak M, Ritz E. Special characteristics of atherosclerosis in chronic renal failure. Clin Nephrol. 2003 Jul;60 Suppl 1:13 – 21 |
Bugger und Abel 2008 | Bugger H, Abel ED. Molecular mechanism for myocardial mitochondrial dysfunction in the metabolic syndrome. Clin Sci. 2008;114:195 – 210 |
Bui et al. 2009 | Bui QT, Prempeh M, Wilensky RL. Atherosclerotic plaque development. Int J Biochem Cell Biol. 2009;41:2109 – 2113 |
Burke et al. 1997 | Burke AP, Farb A, Malcom GT, Liang YH, Smialek J, Virmani R. Coronary risk factors and plaque morphology in men with coronary disease who died suddenly. N Engl J Med. 1997;336:1276 – 1282 |
Dhalla et al. 1998 | Dhalla NS, Liu X, Panagia V, Takeda N. Subcellular remodelling and heart dysfunction in chronic diabetes. Cardiovasc Res. 1998;40:239 – 247 |
Di Bonito et al. 2005 | Di Bonito P, Cuomo S, Moio N, Sibilio G, Sabatini D, Quattrin S, Capaldo B. Diastolic dysfunction in patients with non- |
Fein 1990 | Fein FS. Diabetic cardiomyopathy. Diabetes Care. 1990;13:1169 – 1179 |
Finn et al. 2010 | Finn AV, Nakano M, Narula J, Kolodgie FD, Virmani R. Concept of vulnerable/unstable plaque. Arterioscler Thromb Vasc Biol. 2010;30:1282 – 1292 |
Frustaci et al. 2000 | Frustaci A, Kajstura J, Cimenti C, Jakoniuk I, Leri A, Maseri A, Nadal- |
Hansson 2005 | Hansson GK: Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005;352:1685 – 1695 |
Harloff et al. 2010 | Harloff A, Nussbaumer A, Bauer S, Stalder AF, Frydrychowicz A, Weiller C, Hennig J, Markl M. In vivo assessment of wall shear stress in the atherosclerotic aorta using flow- |
Karch et al. 2005 | Karch R, Neumann F, Ullrich R, Neumueller J, Podesser BK, Neumann M, Schreiner W. The spatial pattern of coronary capillaries in patients with dilated, ischemic, or inflammatory cardiomyopathy. Cardiovasc Pathol. 2005;14:135 – 144 |
Libby 2002 | Libby P. Inflammation in atherosclerosis. Nature. 2002;420:868 – 874 |
Libby et al. 2011 | Libby P, Ridker PM, Hansson GK. Progress and challenges in translating the biology of atherosclerosis. Nature. 2011 May 19;473(7347):317 – 25 |
Liu et al. 2009 | Liu X, Pu F, Fan Y, Deng X, Li D, Li S. A numerical study on the flow of blood and the transport of LDL in the human aorta: the physiological significance of the helical flow in the aortic arch. Am J Physiol Heart Circ Physiol. 2009;297: H163 – H170 |
Lusis 2000 | Lusis AJ. Atherosclerosis. Nature. 2000;407:233 – 241 |
Marks et al. 2004 | Marks DS, Gudapati S, Prisant LM, Weir B, di Donato- |
Monaco et al. 2004 | Monaco C, Andreakos E, Kiriakidis S et al. Canonical pathway of nuclear factor kappa B activation selectively regulates proinflammatory and prothrombotic responses in human atherosclerosis. Proc Natl Acad Sci USA. 2004;101:5634 – 5639 |
Moreno 2010 | Moreno PR. Vulnerable plaque: definition, diagnosis and treatment. Cardiol Clin. 2010;28: 1 – 30 |
Murry et al. 1997 | Murry CE, Gipaya CT, Bartosek T, Benditt EP, Schwartz SM. Monoclonality of smooth muscle cells in human atherosclerosis. Am J Pathol. 1997 Sep;151(3):697 – 705 |
Nordon et al. 2009 | Nordon IM, Hinchliffe RJ, Holt PJ, Loftus IM, Thompson MM. Review of current theories for abdominal aortic aneurysm pathogenesis. Vascular. 2009 Sep- |
Orr et al. 2005 | Orr AW, Sanders JM, Bevard M, Coleman E, Sarembock IJ, Schwartz MA. The subendothelial extracellular matrix modulates NFkappaB activation by flow: a potenzial role in atherosclerosis. J Cell Biol. 2005;169:191 – 202 |
Rizzoni et al. 2003 | Rizzoni D, Porteri E, Boari GE, De Ciuceis C, Sleiman I, Muiesan ML. Prognostic significance of small- |
Russell et al. 2009 | Russell NS, Hoving S, Heeneman S, Hage JJ, Woerdeman LA, de Bree R, Lohuis PJ, Smeele L, Cleutjens J, Valenkamp A, Dorresteijn LD, Dalesio O, Daemen MJ, Stewart FA. Novel insights into pathological changes in muscular arteries of radiotherapy patients. Radiother Oncol. 2009 Sep;92(3):477 – 83. Epub 2009 Jun 21 |
Shimizu et al. 1993 | Shimizu M, Umeda K, Sugihara N, Yoshio H, Ino H, Takeda R, Okada Y, Nakanishi I. Collagen remodelling in myocardia of patients with diabetes. J Clin Pathol. 1993;46:32 – 36 |
Stewart und Dörr 2009 | Stewart F, Dörr W. Milestones in normal tissue radiation biology over the past 50 years: From clonogenic cell survival to cytokine networks and back to stem cell recovery. Int. J. Radiat. Biol. 2009;85:574 – 586 |
Thomas 2011 | Thomas C. Cardiovascular biology. Nature. 2011 May 19;473(7347):297 |
Virmani et al. 2006a | Virmani R, Burke AP, Farb A, Kolodgie FD. Pathology of the vulnerable plaque. J Am Coll Cardiol. 2006;47(8 Suppl):C13 – 8 |
Virmani et al. 2006b | Virmani R, Ladich E, Burke A, Kolodgie F. Histopathology of carotid atherosclerotic disease. Neurosurgery. 2006;59(5 Suppl):219 – 227 |
Werner et al. 2005 | Werner N, Kosiol S, Schiegl T et al. Circulating endothelial progenitor cells and cardiovascular outcomes. N Engl J Med. 2005;353:999 – 1007 |
4 Mögliche Mechanismen des Einflusses von Strahlenexpositionen auf die Pathogenese von Herz-Kreislauferkrankungen
4.1 Einleitung
Das Herz galt lange als der Prototyp eines strahlenresistenten Organs. Man leitete diese Einschätzung aus der geringen Zellteilungsaktivität im Herzen ab, mit seinen postmitotischen Myozyten und der extrem langsamen Proliferationsaktivität der Endothel- und Bindegewebszellen (Lauk und Trott 1990; Schultz-Hector und Trott 2007).
Unerwünschte Effekte nach Strahlenexposition werden zum einen als deterministisch beziehungsweise nach der aktuellen Definition der ICRP als „tissue effects/organ reactions“ (ICRP 2011) angesehen, wenn dieselben nur oberhalb einer bestimmten Schwellendosis auftreten. Diese Strahlenwirkungen werden im Allgemeinen als Ergebnis von Zellabtötung, Zellalterung oder Apoptose einer kritischen Zellanzahl beziehungsweise eines kritischen Zelltyps erwartet. Solche zellabtötenden Effekte sind relativ sicher in die strahleninduzierte Schädigung von Herz-Kreislauf-Strukturen nach hohen Dosen involviert.
Andererseits wird angenommen, dass stochastische Effekte nach sowohl hohen als auch niedrigen Strahlendosen aus persistierenden Veränderungen (einschließlich Mutationen) individueller Zellen und deren klonaler Expansion resultieren. Dies gilt insbesondere für strahleninduzierte maligne Tumoren. Eine Schwellendosis, unterhalb derer ganz sicher kein Effekt, d. h. keine tumorauslösende Mutation ausgelöst wird, kann hier nicht definiert werden.
Gegenwärtig wird das eventuell vorliegende Risiko von Herz-Kreislauferkrankungen nach Strahlenexposition bei der Berechnung des Detriments durch stochastisch induzierte Erkrankungen nicht berücksichtigt. Für niedrige Dosen ist zu erwarten, dass epidemiologische Studien alleine in der nahen Zukunft Evidenz für einen kausalen Zusammenhang zwischen Herz-Kreislauferkrankungen und Strahlenexposition, wenn überhaupt, dann nur mit einer großen Unsicherheit aufzeigen können. Ergänzende mechanistische experimentelle Studien sind deshalb zur Beurteilung des Risikos von Herz-Kreislauferkrankungen nach Strahlenexpositionen mit niedrigen Dosen von Bedeutung.
In diesem Kapitel werden zunächst die hypothetischen Mechanismen, dann die gegenwärtig vorliegenden Erkenntnisse aus den Untersuchungen am Menschen, anschließend die Ergebnisse der tierexperimentellen Untersuchungen und schließlich die Ergebnisse der bisher verfügbaren In-vitro-Untersuchungen sowie deren Möglichkeiten und Limitationen für die Beurteilung strahleninduzierter Effekte auf das Herz-Kreislaufsystem beim Menschen dargestellt.
4.2 Hypothetische Mechanismen
Die Ursachen von Herz-Kreislauferkrankungen, die auch durch Bestrahlung ausgelöst oder beschleunigt werden können, sind, wie im Kapitel 3 ausführlich beschrieben, multifaktoriell. Experimentelle und klinische Beobachtungen legen sowohl für die Entstehung der arteriosklerotischen Primärläsion als auch für die Plaque Destabilisierung nach Strahlenexposition mit hohen Dosen ähnliche Entstehungsmechanismen nahe, wie für die spontane Arteriosklerose. Des Weiteren könnte Strahlenexposition nicht nur als ein unabhängiger Risikofaktor für die Entstehung von Herz-Kreislauferkrankungen wirken, sondern ebenfalls oder alternativ auch die konventionellen, gut etablierten Risikofaktoren beeinflussen.
Ein eindeutiger und überzeugender kausaler biologischer Zusammenhang zwischen Strahlenexposition < 500 mGy und Herz-Kreislauferkrankungen liegt bisher nicht vor. Erschwerend kommt hinzu, dass die arteriosklerotische Läsion unter Umständen Jahrzehnte zur Entstehung braucht, eine hohe strahlenunabhängige spontane Inzidenz aufweist, im Einzelfall keine Rückschlüsse auf die Entstehung zulässt, und dass es gegenwärtig keine biologischen Marker gibt, die den Zusammenhang zwischen Strahlenexposition und Herz-Kreislauferkrankungen verlässlich nachweisen.
Als mögliche biologische Wirkmechanismen für Dosen unter 5 Gy wurden bisher beschrieben:
- –
- Eine monoklonale Entstehung von arteriosklerotischen Plaques (Mutationstheorie; [Benditt und Benditt 1973; Schwartz und Murry 1998]).
- –
- Eine Umwandlung von glatten Muskelzellen aus ruhenden in aktivierte sezernierende innerhalb arteriosklerotischer Pathways (onkogene Aktivierung, LOH und Mikrosatelliteninstabilität; Andreassi 2003).
- –
- Eine entzündungsunabhängige Reduktion der mikrovaskulären Perfusion (Marks et al. 2005; Prosnitz et al. 2007) (siehe Kapitel 4.2.3).
- –
- Radiogene Langzeiteffekte auf das Immunsystem (Kusunoki et al. 1998; Ross 1999; Hansson 2005) (siehe Kapitel 4.3.).
- –
- Entzündungsreaktionen und Veränderungen in Mikrogefäßen (entzündlich/mikro-vaskuläre Theorie; Hansson 2005).
4.2.1 Monoklonale Entstehung von arteriosklerotischen Plaques (Mutationstherorie)
Eine der kontroversesten Hypothesen wurde von Benditt und Benditt (1973) aufgestellt, mit der These, dass menschliche arteriosklerotische Plaques monoklonalen Ursprungs seien. Wie in dem Kapitel 3.3.1 ausführlich beschrieben, sind arteriosklerotische Ablagerungen hauptsächlich aus vaskulären glatten Muskelzellen (SMC), Lipiden und Makrophagen aufgebaut.
Benditt und Benditt (1973) isolierten in ihrer Untersuchung bei weiblichen Patienten Plaques aus unterschiedlichen Verlaufsphasen der Arteriosklerose und untersuchten diese im Hinblick auf die Homo- bzw. Heterozygosität des Glukose-6-Phosphat-Genstatus. Unterschiedliche Ablagerungen, die von derselben Person isoliert wurden, besaßen entweder den Typ A oder Typ B des Enzyms, was auf eine Klonogenität hindeutete. Im Gegensatz dazu zeigten Gewebeproben aus der normalen Gefäßmedia und der Gefäßintima eine Zusammensetzung, die auf einen heterogenen Ursprung schließen ließ.
In Übereinstimmung mit dem klonalen Expansionsmodell für bösartige Tumoren wurde daher die Hypothese aufgestellt, dass die Ursache für arteriosklerotische Ablagerungen eine initiierende Mutation in den SMC sei, die wahrscheinlich durch chemische Mutagene oder Viren verursacht wird und zu arteriosklerotischen Plaques monoklonalen Ursprungs führt. Theoretisch ließe sich so erklären, wie sogar niedrige Strahlendosen Herz-Kreislauferkrankungen induzieren könnten, da ionisierende Strahlung hochgradig mutagen ist.
Mehrere andere Untersuchungen konnten diese Beobachtungen insbesondere im Hinblick auf Mikrosatelliten-Instabilität (Bobik et al. 1999) nicht bestätigen. Des Weiteren ist Klonogenität selbst nicht gleichbedeutend mit Transformation einer einzelnen Zelle. Spätere Untersuchungen konnten zeigen, dass größere Abschnitte der normalen Gefäßmedia monoklonalen Ursprungs sind (Chung et al. 1998). Somit ist Klonogenität viel wahrscheinlicher durch das Vorhandensein sich entwickelnder Klone in der normalen Gefäßwand als durch eine Mutation zu erklären. Eine wesentliche Rolle von DNA-Schäden und von Zelltransformation und insbesondere eine monoklonale Entstehung von arteriosklerotischen Plaques ist gegenwärtig nicht überzeugend belegbar und eher unwahrscheinlich.
4.2.2 Umwandlung glatter Muskelzellen aus ruhenden, kontraktilen SMC zu proliferierenden, sezernierenden SMC
Wie im Kapitel 3.3.1 beschrieben, kommt es bei der Entstehung der arteriosklerotischen Läsion nach der ausgelösten Entzündungsreaktion in der Intima im nächsten Stadium unter anderem unter dem Einfluss von TGF-β zur Umwandlung der glatten Muskelzellen der Gefäßwand (SMC) vom ruhenden, kontraktilen zum proliferierenden, sezernierenden Phänotyp.
Arteriosklerotische Plaques weisen deutliche Anzeichen chromosomaler Veränderungen und chromosomaler Instabilität auf. So wurde sowohl über Mikrosatelliten-Instabilität als auch über den Verlust der Heterozygosität (LOH = loss of heterozygosity) in arteriosklerotischen Plaques berichtet (Hatzistamou et al. 1996; Miniati et al. 2001). Daher untersuchten einige Arbeitsgruppen den Verlust der Heterozygosität (LOH) von Genen arteriosklerotischer Plaques, die bei der Entwicklung von Herz-Kreislauferkrankungen eventuell maßgeblich beteiligt sein könnten (McCaffrey et al. 1997; Grati et al. 2001; Miniati et al. 2001). Auch wurde eine mögliche Rolle für die hohe Mutationsrate des Typ II TGF-beta1-Rezeptor-Gens in Betracht gezogen (McCaffrey et al. 1997). Aber das Vorkommen dieser Mutation in den Plaques stellte sich sehr bald als so selten heraus, dass daraus kein allgemeiner Mechanismus für deren Entwicklung abgeleitet werden konnte (Clark et al. 2001). Bis heute ist es nicht gelungen und nicht möglich, einen speziellen chromosomalen Bereich festzulegen, der entweder kausal oder als genereller Marker ausschlaggebend für eine arteriosklerotische Plaquebildung angesehen werden könnte. Somit ist eine wesentliche Rolle von chromosomalen Veränderungen und von chromosomaler Instabilität als mögliche biologische Mechanismen, die auf die Pathogenese der Arteriosklerose nach Strahlenexpositionen Einfluss nehmen, gegenwärtig nicht überzeugend belegbar und eher unwahrscheinlich.
4.2.3 Entzündungsreaktionen und Veränderungen in Mikrogefäßen (entzündlich/mikrovaskuläre Theorie)
Die zur Entstehung strahleninduzierter Herz-Kreislauferkrankungen führenden Mechanismen sind bisher weitestgehend ungeklärt. Eine wesentliche Rolle von DNA-Schäden und von Zelltransformation wurde in der Vergangenheit vereinzelt diskutiert, scheint aber nicht überzeugend belegbar zu sein. Es scheint jedoch wahrscheinlich, dass Entzündungsreaktionen daran beteiligt sind (Schultz-Hector und Trott 2007; Little et al. 2008, 2010; Schultz-Hector und Hildebrandt, 2009; Hildebrandt, 2010). Untersuchungen von Stewart et al. (2006) konnten belegen, dass hohe Strahlendosen mit einer früheren Ausprägung und gesteigerten Bildung von makrophagenreichen entzündlichen arteriosklerotischen Veränderungen einhergehen und, dass diese wiederum zu Blutungen innerhalb der arteriosklerotischen Plaques neigen und auch eine verminderte myokardiale Perfusion bedingen können.
Sowohl makrovaskuläre als auch mikrovaskuläre Strahlenwirkungen betreffen die Endothelzellen der Gefäßintima (siehe Kapitel 3.3.1) und die Kaskade der Entzündungsmediatoren. Es wird daher vermutet, dass eine Modulation der Entzündungsreaktion wohl die wahrscheinlichste Ursache für strahleninduzierte Herz-Kreislauferkrankungen nach niedriger Strahlenexposition sein könnte. Möglicherweise spielen die Endothelzellen der Gefäßintima eine ausschlaggebende Rolle bei strahleninduzierten Herz-Kreislauferkrankungen. Die Wirkungen auf das Endothel sind jedoch schwer zu bestimmen: Während bei In-situ-Messungen mangelnde Sensitivität und Spezifität problematisch sein können, sind Untersuchungen an Zellkulturen oder an Tiermodellen nur von beschränkter Aussagekraft für den Menschen, da bei diesen Untersuchungen deutlich veränderte Proliferationsraten der Endothelzellen vorliegen. Eine beträchtliche Anzahl an Studien hat Strahlenwirkungen an Endothelzellen in vitro untersucht, und einige Studien konnten manche der dort gemachten Beobachtungen in vivo erhärten (Zusammenfassung in Schultz-Hector und Trott, 2007).
Abschließend muss noch angemerkt werden, dass sich strahleninduzierte Herz-Kreislauferkrankungen hinsichtlich ihres Zeitablaufs (chronisch progressives, über Jahrzehnte ansteigendes Risiko), ihrer Dosis-Wirkungsbeziehungen (eine Schwellendosis konnte bisher nicht definiert werden) und des Entstehungsmechanismus (ein quantitativer Zellverlust ist nicht der entscheidende Mechanismus) von den klassischen deterministischen Strahlenfolgen systematisch unterscheiden.
4.3 Untersuchungen am Menschen
Veränderungen der Bauchaorta werden nur in vereinzelten Fallberichten im Zusammenhang mit einer vorangegangenen Strahlentherapie berichtet. Da sich diese Beobachtungen auf relativ hohe Strahlendosen beziehen und jeweils mit Besonderheiten und spezifischen Umständen verbunden waren, ist daraus kein genereller Hinweis für eine im Rahmen von Strahlenschutz-Überlegungen relevante Strahlenempfindlichkeit der Bauchaorta zu entnehmen.
Während einer kurativen Strahlentherapie können die Dosen für Herz und koronare Arterien sehr hoch sein; so betrug z. B. bei der Behandlung des Morbus Hodgkin für umschriebene Bereiche des Herzens die kumulative Dosis mehr als 40 Gy (McGale und Darby 2005). Bei Patienten mit derart hoher Exposition wurde eine Vielfalt sogenannter „tissue effects“ (ICRP 2011) beobachtet. Diese sind die Folge der Inaktivierung einer großen Zellzahl begleitet von funktionalen Schädigungen des betroffenen Gewebes. Zu solchen Effekten zählt die direkte Zerstörung von Herzstrukturen, deren strukturelle und funktionelle Konsequenzen sich im Allgemeinen innerhalb von Monaten bis zu wenigen Jahren nach der therapeutischen Strahlenexposition manifestieren. Dazu gehören ausgeprägte diffuse Fibrosen insbesondere des Peri- und Myokards, perikardiale Adhäsionen, mikrovaskuläre Schädigungen und Stenosen der Herzklappen und Koronararterien. Solche Veränderungen lassen sich sowohl bei Patienten nach Strahlentherapie als auch bei Versuchstieren nachweisen (Adams et al. 2003).
Vor allem in der Folge früherer, über große mediastinale Felder verabreichter Strahlentherapie des Morbus Hodgkin sind sowohl Einschränkungen der Pumpfunktion des Herzens beschrieben worden als auch Veränderungen der Herzklappen (Burns et al. 1983; Heidenreich et al. 2005). Dieselben Befunde sind auch in jüngeren Langzeituntersuchungen nach 20 Jahren noch persistent (Machann et al. 2011).
Neuere Untersuchungen zeigen, dass in Korrelation zu Strahlenfeldern auch die regionale Myokardfunktion – gemessen mit dem „strain rate imaging“ – nach Strahlentherapie des Mammakarzinoms reduziert ist. Ob diese Befunde jedoch längerfristig bestehen bleiben und über eine anzunehmende Sensibilisierung gegenüber anderen kardialen Belastungen hinausgehende klinisch/symptomatische Relevanz besitzen, geht aus den vorliegenden klinischen Befunden nicht hervor (Erven et al. 2011).
Das Risiko strahleninduzierter Herz- und Hirngefäßerkrankungen steigt nach einer Latenzzeit von 10 Jahren mit weiterem progredientem Verlauf. Ein signifikanter Anstieg wurde bereits bei Herzdosen beobachtet, die lediglich 10 % oder weniger der generell akzeptierten Toleranzdosen von 40 Gy bis 50 Gy betrugen (Schultz-Hector und Trott 2007). Die klinischen Symptome der koronaren Herzerkrankung oder peripherer Arteriosklerosen sind jedoch nicht spezifisch für strahleninduzierte Effekte. Daher ist es im individuellen Fall nicht möglich, die symptomatische Arteriosklerose ursächlich einer Strahlenexposition und nicht anderen Ursachen zuzuordnen.
Obwohl die Mechanismen strahleninduzierter Herz- und Hirngefäßerkrankungen noch nicht verstanden sind, scheinen zumindest nach hohen Strahlendosen sowohl makrovaskuläre als auch mikrovaskuläre Veränderungen involviert zu sein.
Makrovaskuläre Veränderungen sind vor allem durch eine raschere Progression der altersbedingten Arteriosklerose in den Koronargefäßen und großen Arterien gekennzeichnet. Nach linksseitiger Strahlentherapie des Mammakarzinoms erwies sich nicht nur die Inzidenz von Koronarstenosen als höher als nach rechtsseitiger Erkrankung, sondern es zeigte sich auch eine bevorzugte Lokalisation im Bereich der linken vorderen Koronararterie, die eine höhere Dosis erhalten hatte als andere Bereiche des Herzens (Correa et al. 2008). Wichtig ist, dass nicht nur historische sondern auch aktuelle Bestrahlungstechniken mit einem signifikant höheren Arteriosklerose-Risiko verbunden sind (Gutt et al. 2008). Die Beobachtung von arteriosklerotischen Veränderungen der A. mammaria interna nach Exposition im Rahmen einer Strahlentherapie sind deshalb eindrucksvoll, weil diese als geradliniges, unverzweigtes Gefäß von „spontaner“ Arteriosklerose nicht betroffen ist (Russel et al. 2009).
Mikrovaskuläre Veränderungen sind insbesondere durch eine Abnahme der Kapillargefäßdichte charakterisiert und können zu konsekutiven chronischen Durchblutungsstörungen des Herzens und fokaler Degeneration des Myokards führen. Nach Strahlentherapie des linksseitigen Mammakarzinoms wurden mithilfe der SPECT (single photon emission computed tomography) fokale Perfusionsdefizite des Myokards dokumentiert. Die Inzidenz nahm mit der Zeit nach Strahlentherapie und der Dosis zu; die Lokalisation der Perfusionsdefekte korrelierte mit der Dosisverteilung am Herzen (Marks et al. 2005). In einer prospektiven Studie wurde von derselben Gruppe gezeigt, dass diese Veränderungen auch über Beobachtungszeiträume von 3 Jahren und 6 Jahren persistieren (Prosnitz et al. 2007).
Die bisher vorliegenden epidemiologischen Studien, die das kardiovaskuläre Risiko geringerer Strahlendosen oder von Ganzkörperexpositionen untersuchten, beziehen sich dahingegen überwiegend auf symptomatische arteriosklerotische Veränderungen (z. B. Schlaganfall oder Myokardinfarkt; siehe Kapitel 5). Pathologische Veränderungen, die Rückschlüsse auf makrovaskuläre Veränderungen oder die mikrovaskuläre Perfusion zulassen, konnten zumeist nicht erfasst werden, und sind auch ohne aufwändige bildgebende Verfahren nicht zu erfassen.
Es wird davon ausgegangen, dass sowohl makrovaskuläre als auch mikrovaskuläre Veränderungen von Dosis, Dosisverteilung und anderen Risikofaktoren, denen Menschen oder auch Versuchstiere ausgesetzt waren, abhängen und unterschiedliche Latenzperioden bei unterschiedlich hohen Dosen zeigen. In beide Formen kardiovaskulärer Veränderungen sind die Endothelzellen der Gefäßintima (siehe Kapitel 3.3) und pro-inflammatorische Entzündungskaskaden involviert (Hildebrandt, 2010; Little et al. 2008, 2010; Schultz-Hector und Hildebrandt 2009; Schultz-Hector und Trott 2007).
Die epidemiologischen Anhaltspunkte für die Rolle von Entzündungsvorgängen bei der Verursachung kardiovaskulärer Erkrankungen beruhen insbesondere auf Befunden der „Life Span Study“ (LSS) der japanischen Atombombenüberlebenden. Hier fand man viele Jahre nach der Exposition leicht, aber dennoch signifikant erhöhte systemische Entzündungsparameter mit erhöhten Werten von Interleukin 6 (IL 6: 0 Gy: 1,47 pg/ml; 0,005 Gy bis 1,5 Gy: 1,53 pg/ml; > 1,5 Gy: 1,85 pg/ml), TNF-α, IFN-γ und IL-10 (Hayashi et al. 2003, 2005). Andere Entzündungsmarker, wie erhöhte Blutkörperchensenkungsgeschwindigkeit (BSG) und erhöhte Werte des C-reaktiven Proteins, wurden ebenfalls viele Jahre nach Exposition in dieser Kohorte gefunden (Hayashi et al. 2005). Erhöhte Werte von IL-6 fanden sich auch in einer Reihe anderer (nicht strahlenexponierter) Kohorten begleitet von erhöhtem kardiovaskulärem Risiko (Ridker et al. 2000; Tzoulaki et al. 2005).
Weitere, eher indirekte Mechanismen könnten ebenso beteiligt sein. Angesichts der möglichen Bedeutung von Infektionen für kardiovaskuläre Erkrankungen könnten Immundefekte eine indirekte Rolle spielen (Ross 1999; Hansson 2005). Aus Untersuchungen der japanischen Überlebenden ist bekannt, dass die T- und B-Zellpopulationen abhängig von der Strahlendosis (≥ 1,5 Gy) erniedrigt sind (Kusunoki et al. 1998).
Außerdem zeigten die Untersuchungen der japanischen Überlebenden einen Anstieg des Parathormons mit steigender Strahlendosis; dies deutet auf einen weiteren möglichen indirekten Mechanismus für die Auslösung von Bluthochdruck und kardiovaskulären Erkrankungen hin (Fujiwara et al. 1994).
Für eine ausführliche Übersicht und Diskussion des potenziellen Zusammenhangs zwischen diesen systemischen Strahlenwirkungen mit der Entwicklung einer Arteriosklerose und erhöhter kardiovaskulärer Morbidität oder Mortalität bei Atombombenüberlebenden sei auf die kürzlich veröffentlichte Übersicht von Hendry et al. (2008) verwiesen. Bislang gibt es jedoch keinen Hinweis darauf, dass diese beiden möglichen Wirkungen einer Ganzkörperstrahlenexposition kausal zusammenhängen. Somit können gegenwärtig noch keine verbindlichen Aussagen getroffen werden.
4.4 Tierexperimentelle Untersuchungen
Ob kardiovaskuläre Strahlenwirkungen nach Expositionen mit Dosen < 1 Gy sich qualitativ und mechanistisch aus den Wirkungen höherer Dosen ableiten lassen, ist unklar. Im Sinne einer experimentell verfolgenswerten Arbeitshypothese werden im Folgenden jedoch die aus dem höheren Dosisbereich vorliegenden klinischen und experimentellen Befunde zu Veränderungen morphologischer und funktioneller Parameter vorangestellt, anschließend geeignete Tiermodelle für die Untersuchung strahleninduzierter Herz-Kreislauferkrankungen beschrieben und schließlich die wenigen vorliegenden tierexperimentellen Ergebnisse nach Strahlenexposition mit Dosen < 1 Gy zusammengefasst.
4.4.1 Experimentelle Daten zur Strahlenwirkung hoher Strahlendosen
4.4.1.1 Arteriosklerose
Dass die Wahrscheinlichkeit einer lokalen arteriosklerotischen Veränderung in der Folge einer Strahlentherapie im Brustraum erhöht ist, konnte klinisch inzwischen vielfach dokumentiert werden (Darby et al. 2010). Nicht zuletzt aufgrund der geringen spontanen Neigung zur Arteriosklerose sind Wildtyp-Labortiere jedoch keine ausreichend sensitiven Modelle, um in relevanten Dosisbereichen quantitative Untersuchungen zur Strahlenwirkung durchzuführen. In älteren Untersuchungen wurden zwar hohe Dosen eingesetzt, es wurden die Koronararterien jedoch nicht systematisch und quantitativ analysiert.
Die nicht-invasive Früherkennung der Arteriosklerose in subklinischen Studien ist eine notwendige Voraussetzung der Sekundärprävention. In jüngeren Arbeiten wurde deshalb eine Reihe von modernen Methoden vorgeschlagen, die sich möglicherweise auch für longitudinale Beobachtungsstudien nach geringeren Strahlendosen eignen. Dies sind z. B. die CT-basierte Messung des Kalziumgehalts der Koronararterien (Andersen et al. 2010) oder die periphere arterielle Tonometrie (Zelcer et al. 2010).
Gegenwärtig konzentrieren sich systematische experimentelle Studien zur Arteriosklerose nach Bestrahlung ganz auf morphologische Untersuchungen bei ApoE-/-Mäusen. Einerseits ist die morphologische Untersuchung im Experiment die einfachste und zuverlässigste, andererseits ist die Empfindlichkeit der gängigen Versuchstiere für arteriosklerotische Veränderungen so gering, dass funktionelle Veränderungen auch bei vorliegender Arteriosklerose kaum zu erwarten sind. Das am häufigsten untersuchte Tiermodell, die ApoE-/-Maus, entwickelt darüber hinaus gar keine Koronarstenosen, sondern Veränderungen der aufsteigenden Aorta, die wiederum beim Menschen keinen Prädilektionsort der Arteriosklerose darstellt.
Erst kürzlich konnten Stewart und Mitarbeiter (2006) in experimentellen Studien an ApoE-/-Mäusen bei Anwendung hoher, therapeutisch wirksamer Strahlendosen zeigen, dass die Exposition kardiovaskulärer Strukturen mit einer beschleunigten Zunahme und Destabilisierung arteriosklerotischer Läsionen einhergeht (siehe Kapitel 3.3.1; Stewart et al. 2006; Hoving et al. 2008), was möglicherweise zu myokardialen Durchblutungsstörungen führen kann (Prosnitz et al. 2007). Dabei wurden die großen Halsgefäße (A. carotis) von ApoE-/-Mäusen lokal bestrahlt (1 × 14 Gy [Stewart et al. 2006]; 1 × 8 Gy, 20 × 2 Gy [Hoving et al. 2008]). Die Autoren konnten zeigen, dass der Cholesterinwert bei bestrahlten Mäusen gegenüber einer altersgleichen Kontrollgruppe nicht signifikant verändert war. Auch Marker für eine systemische Entzündung waren nicht erhöht. Dennoch entwickelten die Mäuse, die einer hoch dosierten lokalen Bestrahlung ausgesetzt waren, gegenüber der altersgleichen Kontrollgruppe schneller und ausgeprägter makrophagenreiche, entzündliche arteriosklerotische Veränderungen, die zu Blutungen innerhalb der Plaques neigten. Nach einer Einzeitbestrahlung mit 8 Gy waren diese entzündlichen Plaqueveränderungen nicht so ausgeprägt wie nach Bestrahlung mit 14 Gy, was eine Dosisabhängigkeit nahelegt. Diese Studie ist die erste systematische experimentelle Arbeit, die einen Kausalzusammenhang zwischen Bestrahlung und Arteriosklerose belegt und darauf hinweist, dass Strahlenexposition mit hohen Dosen ein unabhängiger Risikofaktor für Arteriosklerose sein könnte.
Ein weiterer Zelltyp, die in arteriosklerotischen Läsionen akkumuliert, ist die Mastzelle. Es besteht die Hypothese, dass in Mastzellen von Lipoprotein rezeptor-defizienten (LDLR-/-) Mäusen durch die Freisetzung der proinflammatorischen Zytokine IL-6 und IFNγ die Genexpression von Kathepsinen und Matrix-Metalloproteinen erhöht ist (Sun et al. 2007). Andererseits zeigten Mastzell-defiziente Ratten nach Einzeitbestrahlung mit 18 Gy (250 kV Röntgenstrahlung) im Vergleich zu unbestrahlten Kontrolltieren stärkere strahleninduzierte Veränderungen, vor allem diastolische Dysfunktion und Anreicherungen vom interstitiellen Kollagen III, was daher zu der Annahme führte, dass Mastzellen eine schützende Funktion besitzen (Boerma et al. 2005).
Die bisher vorhandenen Erkenntnisse sind jedoch noch nicht ausreichend und sollten auch nach Strahlenexposition mit moderaten oder niedrigen Dosen untersucht werden.
4.4.1.2 Fokale Perfusionsstörungen am Myokard
Die bisher vorliegenden klinischen Beobachtungen dosis- und zeitabhängiger sowie chronisch persistierender fokaler Perfusionsstörungen am Myokard nach lokaler Strahlentherapie am Patienten (siehe Kapitel 4.3; Marks et al. 2005; Prosnitz et al. 2007) korrespondieren mit den tierexperimentellen Befunden der reduzierten Kapillardichte (Lauk 1987; Stewart et al., persönliche Kommunikation) und der fokalen Änderung des endothelialen Phänotyps, der durch den konsistenten aber bis heute unverstandenen Verlust der endothelialen alkalischen Phosphatase gekennzeichnet ist (siehe Kapitel 4.4.1.4).
Untersuchungen der Beeinflussung der Perfusion sind bis jetzt auf solche nach hoher Dosisexposition begrenzt; diese Wirkungen sollten auch im Niedrigdosisbereich untersucht werden. Die postmortale Morphometrie der Kapillardichte ist, insbesondere was das Erkennen von zeitlichen Abläufen angeht, wenig sensitiv. Funktionelle, longitudinale Untersuchungen der Myokardperfusion am Versuchstier nach Strahlenexposition des ganzen Herzens oder von definierten Teilen des Herzens stehen noch nicht zur Verfügung. Derzeit verfügbare Methoden der Bildgebung sollten derartige Untersuchungen jedoch auch an Nagetieren und ausgedehnt in die interessierenden Dosisbereiche < 5 Gy und möglicherweise auch < 1 Gy zulassen.
4.4.1.3 Einschränkungen der Pumpfunktion des Herzens
Die klinischen Untersuchungen zu persistierenden Einschränkungen der Pumpfunktion des Herzens nach Exposition mit sehr hohen Dosen (siehe Kapitel 4.3; Burns et al. 1983; Heidenreich et al. 2005; Machann et al. 2011) korrespondieren mit vorliegenden tierexperimentellen Untersuchungen. So konnte im Rattenmodell nach sehr hohen lokalen Strahlendosen am Herzen von 20 Gy trotz schlechter optischer Auflösung auch bei (noch) klinisch asymptomatischen Tieren eine persistierende Reduktion der linksventrikulären Auswurffraktion beschrieben werden (Schultz-Hector et al. 1992).
Gleichzeitig war die Dichte der β-adrenergen Rezeptoren erhöht und die myokardiale Adrenalinsynthese und der Katecholamingehalt des Myokards reduziert. Ex-vivo-Untersuchungen an explantierten, in vitro schlagenden Herzen (Langendorff-Herz) zeigten sich vermutlich aufgrund des fehlenden kompensatorisch positiv ionotropen Einflusses zirkulierender Katecholamine sensitiver (Wondergem et al. 1991). Eine Ausweitung dieser experimentellen Ansätze in relevante Dosisbereiche sowie auch auf sensibilisierte Tiermodelle (siehe unten) sollte heute auch mit nicht-invasiven, für longitudinale Studien geeigneten Techniken möglich sein.
4.4.1.4 Einschränkungen mikrovaskulärer Endothelzellfunktionen
Über den Funktionszustand mikrovaskulärer Endothelzellen am Menschen gibt es naturgemäß nur morphologische Autopsiebefunde. Schon in den allerersten Untersuchungen zu strahleninduzierten Veränderungen am Myokard wurden Anzeichen der entzündlichen Aktivierung von kapillären Endothelzellen beschrieben.
Im Experiment wurden nicht nur diese Beobachtungen bestätigt, sondern es wurde darüber hinaus ein irreversibler, räumlich und zeitlich mit Myokardveränderungen assoziierter Verlust der endothelialen alkalischen Phosphatase-Reaktion beobachtet und in verschiedenen Tiermodellen bestätigt. Weder die molekulare Identität und Funktion des Enzyms noch seine Rolle bei der Entstehung von Strahlenwirkungen am Herz sind klar, wenngleich Veränderungen der Enzymaktivität auch in anderen mikrovaskulären Myokarderkrankungen beschrieben wurde (Koyama und Taka 2010). Dennoch ist eine langfristige strahleninduzierte Veränderung des Phänotyps von überlebenden Endothelzellen von wirkungsmechanistischem Interesse.
Stewart et al. (2006) beobachteten nach hoch dosierter Einzeitbestrahlung (14 Gy, 250 kV Röntgenstrahlung) der beiden großen Halsgefäßarterien (Arteria carotis) von ApoE-/-Mäusen Effekte auf das endotheliale Zytoskelett. So wurden 22 Wochen nach der Strahlenexposition atypische, geschwollene Endothelzellen in den bestrahlten arteriellen Gefäßen beobachtet. Nach fraktionierter Strahlenexposition (20 × 2 Gy, 250 kV Röntgenstrahlung) im gleichen Modell fanden die Untersucher lange Endothelzell-Stränge im Bereich der arterio-sklerotischen Plaques nahe der Karotis-Gabelung (Hoving et al. 2008). Neuere Untersuchungen zeigen auch nach Strahlendosen von 2 Gy signifikante Veränderungen (Stewart et al., persönliche Kommunikation).
Im EU-Projekt CARDIORISK (www.cardiorisk.eu) wurden darüber hinaus Analysen der Überlebens-, Migrations- und Proliferationsfähigkeit von in vivo am intakten Versuchstier strahlenexponierten Endothelzellen untersucht, deren Ergebnisse für die vorliegende Fragestellung hochrelevant sein werden.
Beobachtungen an Endothelzellen in vitro können jedoch nur sehr wenig zur Klärung der kardiovaskulären St wirkung in vivo beitragen, da der in vitro ca. 100-fach gesteigerte Zellumsatz sowie der Verlust der physiologischen Zell-Zell- und Zell-Matrix-Kontakte zu einer grundlegenden Änderung des phänotypischen Programms führt.
4.4.2 Geeignete Tiermodelle für die Untersuchung von Strahlendosen < 1 Gy
Ob einige der oben beschriebenen funktionellen Endpunkte auch für den Bereich niedriger (< 100 mGy) und moderater Strahlendosen (< 1 Gy) relevant sind, ist völlig offen. Hinzu kommt, dass bei der Übertragung der Befunde auf den Menschen zusätzliche kardiovaskuläre Risikofaktoren zu berücksichtigen sind, mit denen die menschliche Lebenssituation in aller Regel behaftet ist.
Die in älteren Experimenten mit sehr hohen Strahlendosen > 10 Gy verwendeten gesunden Nagetiere sind aus folgenden Gründen wenig für eine Analyse von Dosen < 1 Gy geeignet, da:
- –
- bei gesunden Tieren nur mit dezenten, funktionell kompensierbaren Änderungen zu rechnen ist, die darüber hinaus mit relativ geringer Häufigkeit auftreten.
- –
- Nagetiere per se eine hohe kardiovaskuläre Resistenz aufweisen.
Ein systematischer Vergleich verschiedener, kardiovaskulär vorbelasteter Tiermodelle könnte am ehesten relevante Auskunft über die Wirkung von Strahlendosen < 1 Gy geben. Neue, hochauflösende bildgebende Verfahren stehen dabei in zunehmendem Maß für longitudinale, nicht-invasive Studien zur Verfügung (Liu und Rigel 2009; Tsui und Kraitchman 2009; Golestani et al. 2010). Dabei sind für die Analyse und Beeinflussung der Entstehung von arteriosklerotischen Läsionen vor allem genetisch-modifizierte Tiermodelle interessant.
Ein Großteil der Untersuchungen ist an C57BL/6-Mäusen vorgenommen worden, die empfindlicher für Arteriosklerose sind als andere Inzuchtstämme (Paigen et al. 1990). Die ApoE-/-Variante dieser Stämme wurde aufgrund der häufigen Entwicklung spontaner arterieller Läsionen oft in Studien von Herzerkrankungen verwendet. Diesem mutanten Maus-Stamm mangelt es am Hauptliganden des LDL-Rezeptors (LDL= low density lipoprotein). Die Versuchstiere haben deshalb eine erhöhte Plasmakonzentration an Cholesterol (Lutgens et al. 2001). Lipoprotein niederer Dichte ist unabdingbar für die Versorgung des Gewebes mit Cholesterol; in seiner oxidierten Form ist es jedoch mit dem kaskadenartigen Beginn der pathologischen Entwicklung, die zu Herz-Kreislauferkrankungen führen, assoziiert.
Die beiden, in der aktuellen kardiologischen Forschung am meisten verwendeten genetisch-modifizierten Tiermodelle sind daher die ApoE-/-Mäuse und die LDL-Rezeptor defizienten Mäuse (LDLR-/-). Die klinische Relevanz ist jedoch bei beiden Tiermodellen nicht unerheblich dadurch relativiert, dass die Arteriosklerose bevorzugt am aufsteigenden Aortenbogen auftritt – einem Gefäßabschnitt, der als Windkesselgefäß einen ganz speziellen anatomischen Wandaufbau hat. Bei Windkesselgefäßen überwiegen in der Gefäßmedia die elastischen Fasern (Arterien vom elastischen Typ), sodass diese herznahen Gefäße für einen gleichmäßigen Blutstrom während der Systole und Diastole sorgen. Diese Gefäßabschnitte sind beim Menschen kein Prädilektionsort der Arteriosklerose. Die Koronararterien sind in beiden Modellen nur wenig befallen (Russell und Proctor 2006; Dougherty et al. 2009).
Besonders relevant für strahlenbiologische Experimente könnten auch Mausmodelle des Diabetes (Matrougui 2010), des metabolischen Syndroms (Kennedy et al. 2010) oder der Hypertonie (Mourad und Laville 2006) sein, da hier ebenfalls mikrovaskuläre Veränderungen vorliegen und eine Interaktion mit Strahlenwirkungen besonders interessant erscheint.
Ratten sind einerseits in genetisch einheitlichen Inzuchtstämmen verfügbar und andererseits aufgrund ihrer Körpergröße für in-vivo-Untersuchungen besser geeignet als Mäuse. Bislang gibt es aber nur wenige, genetisch manipulierte Krankheitsmodelle der Ratte. Mit der aktuellen Verfügbarkeit neuer Methoden der genetischen Manipulation der Ratte wird sich dieses vermutlich in naher Zukunft ändern (Geurts und Moreno 2010). Für eine Übersicht über aktuell verfügbare kardiovaskuläre Krankheitsmodelle sei auf die Literatur verwiesen (Bader 2010).
Insbesondere Diät-induzierte und spontane Arteriosklerose ist auch bei Hamstern, Kaninchen und Meerschweinchen zu finden. Der wesentliche Nachteil dieser Spezies – vor allem für die Untersuchung der Wirkung kleiner Dosen – ist, dass sie nicht ingezüchtet sind und daher eine höhere interindividuelle Variabilität aufweisen (Singh et al. 2009).
Tierexperimentelle Modelle am Schwein kommen schon allein aufgrund der anatomischen Gegebenheiten der menschlichen Situation näher als andere Tiermodelle und weisen darüber hinaus eine höhere kardiovaskuläre Empfindlichkeit auf als Nagetiere. Allerdings ist die interindividuelle Variabilität höher als bei ingezüchteten Nagetieren. Daher erfordern aussagekräftige Experimente große Gruppengrößen, welche insbesondere vor dem Hintergrund der zur Untersuchung kardiovaskulärer Strahlenwirkungen erforderlichen Beobachtungszeiten und der hohen Haltungskosten höchstens für einzelne, kritisch ausgewählte Experimente finanzierbar sein dürften (Singh et al. 2009). Für eine ausführliche und detaillierte Diskussion sei auf den HPA-Report 2010 verwiesen (HPA 2010).
4.4.3 Experimentelle Daten zur Strahlenwirkung von Strahlendosen < 1 Gy
Das Design früher Tierversuche in Bezug auf kardiovaskuläre Strahleneffekte beinhaltete ausschließlich hohe beziehungsweise sehr hohe Strahlendosen und war nicht für die Untersuchung arteriosklerotischer Veränderungen nach Strahlenexposition ausgelegt, d. h. Koronararterien und periphere Arterien wurden nicht systematisch untersucht.
Eine aktuelle systematische experimentelle Untersuchung konnte einen Kausalzusammenhang zwischen Bestrahlung mit hohen Dosen und Arteriosklerose belegen und somit darauf hinweisen, dass Strahlenexposition mit hohen Dosen ein unabhängiger Risikofaktor für die Arteriosklerose sein könnte (siehe Kapitel 4.4.1.1). In diesen Untersuchungen konnte gezeigt werden, dass lokale Exposition mit hohen Strahlendosen bei ApoE-/-Mäusen die Entwicklung einer Arteriosklerose verstärken und für die Bildung von entzündlichen, thrombotischen Plaques prädisponieren (Stewart et al. 2006; Hoving et al. 2008). Entzündliche und thrombogene Veränderungen der Endothelzellen haben im Allgemeinen einen wichtigen Einfluss auf die Entwicklung arteriosklerotischer Veränderungen (siehe Kapitel 3.3.1), und die Instabilität und mögliche Ruptur der Plaques geht stark mit den klinischen Symptomen einer Arteriosklerose einher (siehe Kapitel 3.3.2).
Systematische tierexperimentelle Arbeiten, die den Zusammenhang zwischen Bestrahlung mit niedrigen (< 100 mGy) oder moderaten (< 1 Gy) Dosen und Arteriosklerose untersuchen, fehlen nahezu vollständig.
Im EU-Projekt CARDIORISK wurde bei C57Bl/6-Mäusen der Effekt niedriger und moderater lokal am Herzen applizierter Strahlendosen auf das mitochondriale Proteom vier Wochen nach Exposition untersucht. Nach 0,2 Gy konnte zwar keine Beeinträchtigung der Herzfunktion beobachtet werden, aber es waren Änderungen der Proteinzusammensetzung nachweisbar, die auf eine Beeinträchtigung des Pyruvatmetabolismus sowie von zytoskelettalen Strukturproteinen schließen lassen. Diese Beobachtungen stimmen mit den Ergebnissen früherer Untersuchungen überein, bei denen 5 und 24 Stunden nach einer Ganzkörperbestrahlung mit 3 Gy eine Zunahme der Lipidperoxidierung und Proteinoxidierung im Herzgewebe nachgewiesen werden konnte (Azimzadeh et al. 2011).
Diese ersten Ergebnisse aus CARDIORISK weisen darauf hin, dass eine entweder unmittelbare oder auch mittelbare Veränderung von Mitochondrien des Herzens eine Rolle bei der Entstehung von Strahlenwirkungen spielen könnte. Eine Zuordnung der beobachteten Effekte zu z. B. Kardiomyozyten oder Endothelzellen ist jedoch derzeit noch nicht möglich, wie auch die Zeit- und Dosisabhängigkeit oder die Assoziation mit klinisch relevanten Endpunkten noch unbekannt sind.
Im Rahmen des integrierten Projektes NOTE (Non-targeted Effects of Ionising Radiation; http://
Die Untersuchungen erfolgten an drei genotypisch verschiedenen Mäusestämmen. Die Versuchstiere waren entweder empfänglich für die Ausprägung einer Arteriosklerose (ApoE-/-; siehe Kapitel 4.4.2) oder empfänglich für die Ausprägung einer Arteriosklerose (ApoE-/-) und gleichzeitig heterozygot für p53 (ApoE-/- p53 +/-). ApoE-/- p53+/-Mäuse wurden verwendet, da deren Heterozygotie für p53 in diesem Tiermodell eine verstärkte Entwicklung arteriosklerotischer Veränderungen auch ohne Strahlenexposition bewirkt. Vermutlich bewirken Variationen von p53 unterschiedliche Modifikationen der Erkrankung, was wiederum die individuelle Empfindlichkeit beim Menschen aufgrund genetischer Unterschiede im gewählten Tiermodell widerspiegeln sollte. Als Kontrolle kamen C57BL/6-Mäuse (ApoE+/+, p53+/+) zum Einsatz, die in gleicher Weise einer Ganzkörperbestrahlung mit hoher Dosisleistung (150 mGy/min) im Vergleich zu relativ niedriger Dosisleistung (1 mGy/min, 100 mGy/Tag, 5 Tage die Woche) unterzogen wurden. Die Versuchstiere wurden verschiedenen Strahlendosen (0; 0,025; 0,05; 0,1; 0,5 und 2,0 Gy) in einem frühen (8 Wochen alte Tiere) oder späten Krankheitsstadium (8 Monate alte Tiere) ausgesetzt.
3 und 6 Monate nach früher beziehungsweise 2 und 4 Monate nach später Strahlenexposition wurden verschiedene experimentelle Parameter analysiert. Insbesondere erfolgte eine Analyse des zeitlichen Verlaufs der Entstehung und Entwicklung einer Arteriosklerose anhand morphologischer Parameter (Läsionsanalyse an der Lumenoberfläche der Aorta; Lokalisation, Anzahl, Größe/Fläche und Stadium der arteriosklerotischen Plaques der Aortenwurzel; immunhistochemische Analyse des Herzgewebes) und laborchemischer Parameter (Serumcholesterol, Serum-Lipoproteinprofil, Cholesterolverteilung; Zytokine, Adhäsionsmoleküle und thrombogene Marker im Serum) (siehe Abbildung 4.1).
Abbildung 4.1: In Tierversuchen am ApoE-/- -Mausmodell analysierte Zeitverläufe und Parameter, die jeweils am gleichen Versuchstier gemessen und miteinander korreliert wurden (zum Beispiel Anzahl, Größe und Schweregrad arteriosklerotischer Plaques im Bereich der Aortenwurzel (a und b); Läsionsanalyse der Lumenoberfläche der Aorta (c); immunhistochemische Analyse des Herzgewebes; Serumcholesterol, Serum-Lipoproteinprofil, Cholesterolverteilung; Zytokine, Adhäsionsmoleküle und thrombogene Marker im Serum etc.).
Die experimentellen Ergebnisse weisen darauf hin, dass Ganzkörperexposition genetisch empfindlicher Versuchstiere mit niedrigen und moderaten Strahlendosen in Abhängigkeit von Dosis und Dosisleistung sowie Arteriosklerosestadium zum Zeitpunkt der Exposition gegenüber den untersuchten Parametern der Arterioskleroseprogression eine möglicherweise protektive Wirkung vermittelt (Mitchel et al. 2011). Insbesondere waren nach niedrigen Dosen (25 mGy bis 50 mGy), die mit relativ niedriger Dosisleistung (1 mGy/min) entweder im frühen oder späten Arteriosklerosestadium appliziert wurden, die morphologischen Parameter der Arterioskleroseprogression erniedrigt. Manche Effekte waren auch Monate nach Einzeitexposition noch nachweisbar, andere lediglich vorübergehend. Im Gegensatz zur Exposition mit niedrigerer Dosisleistung waren nach Exposition mit hoher Dosisleistung zum frühen Erkrankungszeitpunkt sowohl erniedrigte als auch erhöhte morphologische Parameter der Arterioskleroseprogression nachweisbar, was darauf hinweisen könnte, dass niedrige Dosen und niedrige Dosisleistung die Erkrankungsprogression über andere biologische Mechanismen modulieren könnte, und dass die Dosisleistung möglicherweise ein wichtiger Einflussfaktor ist.
Diese experimentellen Beobachtungen stehen somit im Widerspruch zu der Annahme, man könne die bekannten, in der Regel nachteiligen Effekte einer Strahlenexposition mit hohen Dosen auf die Arterioskleroseprogression direkt auch auf niedrigere Strahlenexpositionen extrapolieren. Die Ergebnisse legen des Weiteren nahe, dass eine lineare Extrapolation der bekannten kardiovaskulären Risiken aus dem Hochdosis- in den Niedrigdosisbereich möglicherweise nicht geeignet ist (Mitchel et al. 2011).
Bei der Interpretation der Ergebnisse muss allerdings berücksichtigt werden, dass die vorliegende experimentelle Untersuchung die Effekte einer Einzeit-Ganzkörperexposition untersucht und die einzige bisher vorliegende tierexperimentelle Arbeit in diesem Dosisbereich ist. Die Effekte wiederholter Expositionen oder einer chronischen Exposition mit niedriger Dosisleistung müssen noch untersucht und die bisher vorliegenden Ergebnisse zwingend in einem alternativen Arteriosklerosemodell bestätigt werden.
Obwohl diese ersten molekularen Ergebnisse nach niedrigeren Dosen nahelegen, dass Veränderungen molekularer Signalkaskaden persistierend nachweisbar sein können, bleibt gegenwärtig offen, welche biologische Bedeutung solche Veränderungen im Hinblick auf eine Beeinflussung von Herz-Kreislauferkrankungen nach Strahlenexposition haben könnten.
4.5 In-vitro-Untersuchungen
Über mögliche zelluläre und molekulare Mechanismen und Zusammenhänge zwischen Strahlenexposition und Herz-Kreislauferkrankungen im Allgemeinen ist bisher nur sehr wenig bekannt. Grundsätzlich ist es zwar möglich, strahleninduzierte Veränderungen nach niedrigen (< 100 mGy) und moderaten (< 1 Gy) Strahlendosen anhand mehrerer molekularer Endpunkte mit Hilfe von in-vitro-Zellmodellen zu analysieren. Aber die jahrelange Latenzzeit zwischen Strahlenexposition und dem Auftreten klinisch relevanter Symptome sowie die Komplexität der darüber hinaus nicht abschließend bekannten klinisch relevanten Endpunkte machen es außerordentlich schwer, diejenigen frühen zellulären und molekularen Veränderungen zu identifizieren, die an der Entstehung von relevanten Spätfolgen beteiligt sind.
Gegenwärtig fehlt eine mechanistische Verbindung zwischen einer Exposition mit niedrigen oder moderaten Strahlendosen und der Entwicklung von Herz-Kreislauferkrankungen, wie sie aufgrund der aktuellen epidemiologischen Studien vermutet wird (siehe Kapitel 5). Dies beruht zum Teil auf dem Mangel an geeigneten Tiermodellen für die humane Situation (siehe Kapitel 4.4.2). Es gibt durchaus Hinweise dafür, dass die strahleninduzierten molekularen Mechanismen, die zu Herz-Kreislauferkrankungen führen, sich prinzipiell von der Pathologie der sporadischen Erkrankungsformen unterscheiden. Während Turbulenzen des Blutflusses und vermehrte Scherkräfte, wie sie z. B. an Gefäßverzweigungen auftreten, eine notwendige Voraussetzung für die Entstehung der spontanen Arteriosklerose darstellen, kann strahleninduzierte Arteriosklerose offenbar auch in Abwesenheit derselben entstehen (siehe Kapitel 3.3.2). Russel et al. (2009) konnten darüber hinaus zeigen, dass nach hoch dosierter Bestrahlung im Vergleich zur spontanen Arteriosklerose eine unterschiedliche Zusammensetzung der arteriosklerotischen Plaques (höherer Proteoglykangehalt) resultiert.
Des Weiteren kommt der Strahlenexposition im Zusammenhang mit anderen Risikofaktoren eine zusätzliche Bedeutung im Sinne eines weiteren Risikofaktors zu, der entweder direkt zu Beginn der Erkrankung oder im zeitlichen Verlauf derselben eintreten kann bzw. auch beides (Hoving et al. 2008). Daher ist es relevant, die molekularen Mechanismen, die eine Rolle in der Ätiologie der sporadischen Herz-Kreislauferkrankungen im Allgemeinen spielen, auch nach Strahlenexposition zu untersuchen.
Wie im Kapitel 3.3.1 ausführlich beschrieben, sind die von einer NFkappa-B-Induktion angeführte Auslösung pro-inflammatorischer Signalketten in Endothelzellen (Monaco 2004; Orr 2005), die nachfolgende Adhäsion und Einwanderung von Leukozyten in die Gefäßwand und schließlich die vermehrte Freisetzung von Sauerstoffradikalen durch sowohl aktivierte Endothelzellen als auch Leukozyten (Teupser et al. 2002), die wiederum das in der Gefäßwand akkumulierende LDL zu OxLDL oxidieren, was wiederum die endotheliale Expression von Adhäsionsmolekülen, Selektinen und Zytokinen stimuliert, für die Entstehung der arteriosklerotischen Läsion mit ausschlaggebend. Es wird somit davon ausgegangen, dass Entzündungen und die damit einhergehende erhöhte Bildung reaktiver Sauerstoffverbindungen (ROS: reactive oxygen species; z. B. Wasserstoffperoxid, Superoxid und Hydroxyl-Radikale) in nahezu allen Stadien der spontanen Arteriosklerose, insbesondere ihrer initialen Phase, beteiligt sind (Hansson 2005; Ramos et al. 2007; Ross 1999). Des Weiteren gibt es Hinweise, dass bei spontaner Arteriosklerose nachweisbare DNA-Schäden wahrscheinlicher durch reaktive Sauerstoffverbindungen als durch direkte exogene Einwirkungen hervorgerufen werden (Mercer et al. 2007).
Oxidativer Stress spielt somit, im Gegensatz zu Mutationen, im gesamten Prozess der Initiation und Progression von Herz-Kreislauferkrankungen eine wichtige Rolle. ROS und reaktive Stickstoff-Spezies (RNS – reactive nitrogen species) werden sowohl während der Genese der Arteriosklerose als auch bei fortgeschrittener Arteriosklerose erzeugt, besonders durch Makrophagen, aber auch durch glatte Gefäßmuskelzellen (SMC) und Endothelzellen (EC), (Bennett 2001). Wasserstoffperoxid (H2O2), eine reaktive ROS-Spezies, die die Lipidmembranen durchdringt, ist in der Lage, Schäden an multiplen zellulären Komponenten zu erzeugen, wie Lipiden, Proteinen und der DNA (Allan et al. 1988; Eny et al. 2005). ROS kann oxidativen Stress auslösen, der bekanntermaßen zu vaskulären Erkrankungen und zur Dysfunktion von Endothelzellen beiträgt (Coyle und Kader 2007). Während hohe ROS-Konzentrationen direkt die Gefäßwände schädigen, stimulieren niedrige ROS-Konzentrationen Veränderungen von Signalwegen und der Gen-Expression, die die Gefäßfunktion modulieren können (Wolf 2000). Obwohl die Rolle von ROS bei der Ätiologie von Herz-Kreislauferkrankungen unumstritten ist, sind doch viele Fragen hinsichtlich des Ursprungs und der hauptsächlichen zellulären Zielstrukturen von ROS noch offen. Bei den meisten Geweben ist die wesentliche Ursache der Wirkung von ROS der Komplex I und Komplex III der Atmungskette in den Mitochondrien (Lambert und Brand 2009).
Im Rahmen des CARDIORISK-Projekts wurden Änderungen des Proteoms humaner Endothelzelllinien in vitro nach Exposition mit 200 mGy analysiert, die Hinweise auf eine mögliche strahleninduzierte Modulation endothelialer oxidativer Stressantworten geben. Nach 4 und 24 Stunden fanden sich insbesondere Änderungen der Ran- und RhoA-Signalwege, die beide schon in diversen experimentellen Situationen mit oxidativen Stressreaktionen in Zusammenhang gebracht worden sind (Pluder et al. 2011).
4.6 Literaturverzeichnis
Adams et al. 2003 | Adams MJ, Hardenbergh PH, Constine LS, Lipshultz SE. Radiation- |
Allan et al. 1988 | Allan IM, Vaughan AT, Milner AE, Lunec J, Bacon PA. Structural damage to lymphocyte nuclei by H2O2 or gamma irradiation is dependent on the mechanism of OH radical production. Br J Cancer. 1988;58:34 – 37 |
Andersen et al. 2010 | Andersen R, Wethal T, Günther A, Fosså A, Edvardsen T, Fosså SD, Kjekshus J. Relation of coronary artery calcium score to premature coronary artery disease in survivors > 15 years of Hodgkin’s lymphoma. Am J Cardiol. 2010;105:149 – 152 |
Andreassi 2003 | Andreassi MG. Coronary atherosclerosis and somatic mutations: an overview of the contributive factors for oxidative DNA damage. Mutat Res. 2003;543:67 – 86 |
Azimzadeh et al. 2011 | Azimzadeh O, Scherthan H, Sarioglu H, Barjaktarovic Z, Conrad M, Vogt A, Calzada- |
Bader 2010 | Bader M. Rat Models of Cardiovascular Diseases. Methods Mol Biol. 2010;597:403 – 414. |
Barjaktarovic et al. 2011 | Barjaktarovic Z, Schmaltz D, Shyla A, Azimzadeh O, Schulz S, Haagen J, Dörr W, Sarioglu H, Schäfer A, Atkinson MJ, Zischka H, Tapio S. Ionizing Radiation Impairs the Respiratory Complexes CI and CIII in Mouse Heart Mitochondria. PLOS One. 2011;6:e27811 |
Benditt und Benditt 1973 | Benditt EP and Benditt JM. Evidence for a monoclonal origin of human atherosclerotic plaques. Proc Natl Acad Sci USA. 1973;70:1753 – 1756 |
Bennett 2001 | Bennett MR. Reactive oxygen species and death: oxidative DNA damage in atherosclerosis. Circ Res. 2001;88:648 – 650 |
Bobik et al. 1999 | Bobik A, Agrotis A, Kanellakis P, Dilley R, Krushinsky A, Smirnov V, Tararak E, Condron M, Kostolias G. Distinct patterns of transforming growth factor- |
Boerma et al. 2005 | Boerma M, Wang J, Wondergem J, Joseph J, Qiu X, Kennedy RH, Hauer- |
Burns et al. 1983 | Burns RJ, Bar- |
Chung et al. 1998 | Chung IM, Schwartz SM, Murry CE. Clonal architecture of normal and atherosclerotic aorta. Implications for atherogenesis and vascular development. Am J Pathol. 1998;152:913 – 923 |
Clark et al. 2001 | Clark KJ, Cary NR, Grace AA, Metcalfe JC. Microsatellite mutation of type II transforming growth factor- |
Correa et al. 2008 | Correa CR, Das IJ, Litt HI, Ferrari V, Hwang WT, Solin LJ, Harris EE. Association between tangential beam treatment parameters and cardiac abnormalities after definitive radiation treatment for left- |
Coyle und Kader 2007 | Coyle CH, Kader KN. Mechanisms of H2O2- |
Darby et al. 2010 | Darby SC, Cutter DJ, Boerma M, Constine LS, Fajardo LF, Kodama K, Mabuchi K, Marks LB, Mettler FA, Pierce LJ, Trott KR, Yeh ET, Shore RE. Radiation- |
Daugherty et al. 2009 | Daugherty A, Lu H, Howatt DA, Rateri DL. Modes of defining atherosclerosis in mouse models: relative merits and evolving standards. Methods Mol Biol. 2009;573:1 – 15 |
Eny et al. 2005 | Eny KM, El- |
Erven et al. 2011 | Erven K, Jurcut R, Weltens C, Giusca S, Ector J, Wildiers H, Van den Bogaert W, Voigt JU. Acute Radiation Effects on Cardiac Function Detected By Strain Rate Imaging in Breast Cancer Patients. Int J Radiat Oncol Biol Phys. 2011;79:1444 – 1451 |
Fujiwara et al. 1994 | Fujiwara S, Sposto R, Shiraki M, Yokoyama N, Sasaki H, Kodama K, Shimaoka K. Levels of parathyroid hormone and calcitonin in serum among atomic bomb survivors. Radiat Res. 1994;137:96 – 103 |
Geurts und Moreno 2010 | Geurts AM, Moreno C. Zinc- |
Golestani et al. 2010 | Golestani R, Wu C, Tio RA, Zeebregts CJ, Petrov AD, Beekman FJ, Dierckx RA, Boersma HH, Slart RH. Small- |
Grati et al. 2001 | Grati FR, Ghilardi G, Sirchia SM, Massaro F, Cassani B, Scorza R, De Andreis C, Sironi E, Simoni G. Loss of heterozygosity of the NOS3 dinucleotide repeat marker in atherosclerotic plaques of human carotid arteries. Atherosclerosis. 2001;159:261 – 267 |
Gutt et al. 2008 | Gutt R, Correa CR, Hwang WT, Solin LJ, Litt HI, Ferrari VA, Harris EE. Cardiac morbidity and mortality after breast conservation treatment in patients with early- |
Hansson 2005 | Hansson GK. Inflammation, atherosclerosis and coronary artery disease. N Engl J Med. 2005;352:1685 – 1695 |
Hatzistamou et al. 1996 | Hatzistamou J, Kiaris H, Ergazaki M, Spandidos DA. Loss of heterozygosity and microsatellite instability in human atherosclerotic plaques. Biochem Biophys Res Commun. 1996; 225:186 – 190 |
Hayashi et al. 2003 | Hayashi T, Kusunoki Y, Hakoda M, Morishita Y, Kubo Y, Maki M, Kasagi F, Kodama K, Macphee DG, Kyoizumi S. Radiation dose- |
Hayashi et al. 2005 | Hayashi T, Morishita Y, Kubo Y, Kusunoki Y, Hayashi I, Kasagi F, Hakoda M, Kyoizumi S, Nakachi K. Long- |
Heidenreich et al. 2005 | Heidenreich PA, Hancock SL, Vagelos RH, Lee BK, Schnittger I. Diastolic dysfunction after mediastinal irradiation. Am Heart J. 2005;150:977 – 982 |
Hendry et al. 2008 | Hendry JH, Akahoshi M, Wang LS, Lipshultz SE, Stewart FA, Trott KR. Radiation- |
Hildebrandt 2010 | Hildebrandt G. Non- |
Hoving et al. 2008 | Hoving S, Heeneman S, Gubels MJJ, te Poele JAM, Russel NS, Daemen MJAP, Stewart FA. Single- |
HPA 2010 | Health Protection Agency. Circulatory Disease Risk – Report of the independent Advisory Group on Ionising Radiation. Documents of the Health Protection Agency – Radiation, Chemical and Environmental Hazards. ISBN 978- |
ICRP 2011 | ICRP. Early and late effects of radiation in normal tissues and organs: threshold doses for tissue reactions and other non- |
ICRP 2011 | ICRP. Statement on tissue reactions. 21 April 2001;Ref. 4825- |
Kennedy et al. 2010 | Kennedy AJ, Ellacott KL, King VL, Hasty AH. Mouse models of the metabolic syndrome. Dis Model Mech. 2010;3:156 – 166 |
Koyama und Taka 2010 | Koyama T, Taka A. Renal vasoconstriction in rats causes a decrease in capillary density and an increase in alkaline phosphatase expression in cardiac capillary nets. Adv Exp Med Biol. 2010;662:83 – 88 |
Kusunoki et al. 1998 | Kusunoki Y, Kyoizumi S, Hirai Y, Suzuki T, Nakashima E, Kodama K, Seyama T. Flow cytometry measurements of subsets of T, B and NK cells in peripheral blood lymphocytes of atomic bomb survivors. Radiat Res. 1998;150:227 – 236 |
Lambert und Brand 2009 | Lambert AJ, Brand MD. Reactive oxygen species production by mitochondria. Mol Biol. 2009;554:165 – 181 |
Lauk 1987 | Lauk S. Endothelial alkaline phosphatase activity loss as an early stage in the development of radiation- |
Lauk und Trott 1990 | Lauk S and Trott KR. Endothelial proliferation in the rat heart following local heart irradiation. Int J Radiat Biol. 1990;57:1017 – 1030 |
Little et al. 2008 | Little MP, Tawn EJ, Tzoulaki I, Wakeford R, Hildebrandt G, Paris F, Tapio S, Elliott P. A systematic review of epidemiological associations between low and moderate doses of ionizing radiation and late cardiovascular effects, and their possible mechanisms. Radiat Res. 2008;169:99 – 109 |
Little et al. 2009 | Little MP, Tawn EJ, Tzoulaki I, Wakeford R, Hildebrandt G, Tapio S, Elliot P. Comments: The non- |
Little et al. 2010 | Little MP, Tawn EJ, Tzoulaki I, Wakeford R, Hildebrandt G, Paris F, Tapio S, Elliott P. Review and meta- |
Liu und Rigel 2009 | Liu J, Rigel DF (2009). Echocardiographic examination in rats and mice. Methods Mol Biol. 2009;573:139 – 155 |
Lutgens et al. 2001 | Lutgens E, de Muinck ED, Heeneman S, Daemen MJ. Compensatory enlargement and stenosis develop in apoE(- |
Machann et al. 2011 | Machann W, Beer M, Breunig M, Störk S, Angermann C, Seufert I, Schwab F, Kölbl O, Flentje M, Vordermark D. Cardiac Magnetic Resonance Imaging Findings in 20- |
Marks et al. 2005 | Marks LB, Yu X, Prosnitz RG, Zhou SM, Hardenbergh PH, Blazing M, Hollis D, Lind P, Tisch A, Wong TZ, Borges- |
Matrougui 2010 | Matrougui K. Diabetes and microvascular pathophysiology: role of epidermal growth factor receptor tyrosine kinase. Diabetes Metab Res Rev. 2010;26:13 – 16 |
McCaffrey et al. 1997 | McCaffrey TA, Du B, Consigli S, Szabo P, Bray PJ, Hartner L, Weksler BB, Sanborn TA, Bergman G, Bush HL, Jr. Genomic instability in the type II TGF- |
McGale und Darby 2005 | McGale P, and Darby SC. Low doses of ionizing radiation and circulatory diseases: a systematic review of the published epidemiological evidence. Radiat Res. 2005;163:247 – 257 |
Mercer et al. 2007 | Mercer J, Mahmoudi M, Bennett M. DNA damage, p53, apoptosis and vascular disease. Mutat Res. 2007;621:75 – 86 |
Miniati et al. 2001 | Miniati P, Sourvinos G, Michalodimitrakis M, Spandidos DA. Loss of heterozygosity on chromosomes 1, 2, 8, 9 and 17 in cerebral atherosclerotic plaques. Int J Biol Markers. 2001;16:167 – 171 |
Mitchel et al. 2011 | Mitchel REJ, Hasu M, Bugden M, Wyatt H, Little MP, Gola A, Hildebrandt G, Priest ND, Whitman SC. Low Dose Radiation Exposure and Atherosclerosis in ApoE- |
Mourad und Laville 2006 | Mourad JJ, Laville M. Is hypertension a tissue perfusion disorder? Implications for renal and myocardial perfusion. J Hypertens Suppl. 2006;24:10 – 16 |
Paigen et al. 1990 | Paigen B, Ishida BY, Verstuyft J, Winters RB, Albee D. Atherosclerosis susceptibility differences among progenitors of recombinant inbred strains of mice. Arteriosclerosis. 1990;10:316 – 323 |
Pluder et al. 2011 | Pluder F, Barjaktarovic Z, Azimzadeh O, Mörtl S, Krämer S, Steininger S, Sarioglu H, Leszczynski D, Nylund R, Hakanen A, Sriharshan A, Atkinson MJ, Tapio S. Low- |
Preston et al. 2003 | Preston DL, Shimizu Y, Pierce DA, Suyama A, Mabuchi, K. Studies of mortality of atomic bomb survivors. Report 13: Solid cancer and noncancer disease mortality: 1950–1997. Radiat Res. 2003;160:381 – 407 |
Prosnitz et al. 2007 | Prosnitz RG, Hubbs JL, Evans ES, Zhou SM, Yu X, Blazing MA, Hollis DR, Tisch A, Wong TZ, Borges- |
Ramos et al. 2007 | Ramos KS, Partridge CR, Teneng I. Genetic and molecular mechanisms of chemical atherogenesis. Mutat Res. 2007;621:18 – 30 |
Ridker et al. 2000 | Ridker PM, Rifai N, Stampfer MJ, Hennekens CH. Plasma concentration of interleukin- |
Ross 1999 | Ross R. Atherosclerosis: an inflammatory disease. N Engl J Med. 1999;340:115 – 126 |
Russel et al. 2009 | Russel NS, Hoving S, Heeneman S, Hage JJ, Woerdeman LA, de Bree R, Lohuis PJ, Smeele L, Cleutjens J, Valenkamp A, Dorresteijn LD, Dalesio O, Daemen MJ, Stewart FA. Novel insights into pathological changes in muscular arteries of radiotherapy patients. Radiother Oncol. 2009;92:477 – 483 |
Russell und Proctor 2006 | Russell JC, Proctor SD. Small animal models of cardiovascular disease: tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis. Cardiovasc Pathol. 2006;15:318 – 330 |
Schultz- | Schultz- |
Schultz- | Schultz- |
Schultz- | Schultz- |
Schwartz und Murry 1998 | Schwartz SM, and Murry CE. Proliferation and the monoclonal origins of atherosclerotic lesions. Annu Rev Med. 1998;49:437 – 460 |
Shimizu et al. 2010 | Shimizu Y, Kodama K, Nishi N, Kasagi F, Suyama A, Soda M, Grant EJ, Sugiyama H, Sakata R, Shore RE. Radiation exposure and circulatory disease risk: Hiroshima and Nagasaki atomic bomb survivor data, 1950–2003. BMJ. 2010;340:b5349 |
Singh et al. 2009 | Singh V, Tiwari RL, Dikshit M, Barthwal MK. Models to study atherosclerosis: a mechanistic insight. Curr Vasc Pharmacol. 2009;7:75 – 109 |
Sponsler und Cameron 2005 | R. Sponsler R, Cameron JR. Nuclear shipyard worker study (1980–1988): a large cohort exposed to low- |
Stewart et al. 2006 | Stewart FA, Heenemann S, te Poele J. Ionizing radiation accelerates the development of atherosclerotic lesions in ApoE- |
Sun et al. 2007 | Sun J, Sukhova GK, Wolters PJ, Yang M, Kitamoto S, Libby P, MacFarlane LA, Mallen- |
Tsui und Kraitchman 2009 | Tsui BM, Kraitchman DL. Recent advances in small- |
Tzoulaki et al. 2005 | Tzoulaki I, Murray GD, Lee AJ, Rumley A, Lowe GD, Fowkes FG. C- |
Wolf 2000 | Wolf G. Free radical production and angiotensin. Curr Hypertens Rep. 2000;2:167 – 73 |
Wondergem et al. 1991 | Wondergem J, van der Laarse A, van Ravels FJ, van Wermeskerken AM, Verhoeve HR, de Graaf BW, Leer JW. In vitro assessment of cardiac performance after irradiation using an isolated working rat heart preparation. Int J Radiat Biol. 1991;59:1053 – 1068 |
Yamada et al. 2005 | Yamada M, Naito K, Kasagi F, Masunari N, Suzuki G. Prevalence of atherosclerosis in relation to atomic bomb radiation exposure: an RERF Adult Health Study. Int J Radiat Biol. 2005;81:821 – 826 |
Zelcer et al. 2010 | Zelcer S, Chen B, Mangel J, Vujovic O, Thiessen- |
5 Epidemiologische Studien des Strahlenrisikos
5.1 Einleitung
Neben den Risiken hoher kardiovaskulärer Strahlendosen ist aufgrund der großen Häufigkeit kardiovaskulärer Erkrankungen die Frage von Bedeutung, ob und welche Risiken für das kardiovaskuläre System durch niedrige und moderate Strahlendosen und Strahlendosisraten bedingt werden. Epidemiologische Ergebnisse zu dieser Frage liegen aus einer Reihe neuerer Untersuchungen vor, die hier vorgestellt und diskutiert werden. Neben neuen Ergebnissen der Studie an Überlebenden aus Hiroshima und Nagasaki sind besonders aktuelle Daten von Beschäftigen des sowjetischen Majak-Komplexes sowie Ergebnisse aus anderen Untersuchungen bei beruflich strahlenexponierten Personen bedeutsam.
Neben der Frage, ob überhaupt Risikoerhöhungen aufgrund von Strahlenexpositionen vorliegen, gilt das besondere Interesse bei der Prüfung der vorliegenden Studien der Frage der Dosis-Wirkungsbeziehungen im Bereich unterhalb von ca. 1 Gy.
Die epidemiologische Forschung hat eine Reihe wichtiger Risikofaktoren für kardiovaskuläre Erkrankungen beschrieben. Dazu gehören neben Alter und männlichem Geschlecht insbesondere das Rauchen, erhöhte Cholesterinwerte, Adipositas, Diabetes, erhöhter Alkoholkonsum, mangelnde körperliche Aktivität sowie der sozioökonomische Status. Diese Einflussfaktoren sind bei der Beurteilung der Frage, ob Exposition gegenüber ionisierenden Strahlen das kardiovaskuläre Risiko beeinflussen, zu beachten. Details zu den bekannten Ursachen von Herz-Kreislauferkrankungen finden sich in Kapitel 2.
5.2 Methodische Aspekte
5.2.1 Literaturrecherche
Mittels einer gezielten Literaturrecherche in der Pubmed-Datenbank sowie der Sichtung der Literaturverzeichnisse vorliegender Studien wurden relevante Publikationen ausgewählt. Es wurden nur Studien bei Menschen einbezogen, die mit einer Kombination der Begriffe „ionizing radiation“, „epidemiology“, „cardiovascular“ und „risk“ bzw. entsprechend verwandter Begriffe aufgefunden wurden. Arbeiten, die sich ausschließlich auf alpha-Strahlung (z. B. Radon) bezogen, wurden nicht berücksichtigt. Die Literaturdatenbanksuche ergab 68 Treffer bei Beschränkung der Suche auf die Jahre 2000 bis 2010. Von diesen wurden durch ein Review der Titel und Abstracts elf Publikationen zu epidemiologischen Primärstudien als relevant für eine detaillierte Darstellung identifiziert, da sie epidemiologische Risikoschätzungen für einen oder mehrere Herz-Kreislauf-Endpunkte enthielten. Weiterhin wurden neun Reviews oder wissenschaftliche Berichte (BEIR, AGIR; UNSCEAR) sowie drei Arbeiten mit weniger detaillierten Risikoangaben einbezogen. Zu medizinisch-therapeutischen Strahlenexpositionen und Herz-Kreislaufrisiko wurden zwei ältere Arbeiten mit Risikoschätzungen identifiziert und eingeschlossen. Vier Publikationen der Jahre 2011 und 2012 wurden im Lauf der Texterstellung von der Arbeitsgruppe als bedeutsam für die epidemiologische Evidenz eingeschätzt und ebenfalls aufgenommen.
In jüngerer Zeit wurde eine Reihe von Übersichtsarbeiten zur Frage kardiovaskulärer Risiken durch niedrige Strahlendosen veröffentlicht (Hoel 2006; Mc Gale und Darby 2008; Little et al. 2010). Zudem ist der UNSCEAR 2006-Bericht (UNSCEAR 2008) eine bedeutsame Quelle für diese zusammenfassende Betrachtung vorliegender Studien zur Thematik.
Die für die Risikobetrachtung bisher analysierten und für die vorliegende Aufgabenstellung relevanten Populationen sind:
- –
- Überlebende der Atombombenabwürfe von Hiroshima und Nagasaki
- –
- Patienten in Diagnostik und (niedrig dosierter) Therapie
- –
- Beruflich Exponierte einschließlich der Majak-Arbeiter
- –
- Exponierte nach dem Tschernobyl-Unfall.
Nicht einbezogen werden in die vorliegende Betrachtung Studien an Patienten mit hohen internen Dosen (z. B. nach Thorotrast-Applikation) sowie Untersuchungen an gynäkologischen Tumorpatientinnen.
5.2.2 Endpunkte
Bei der Untersuchung kardiovaskulärer Folgen von ionisierender Strahlung werden in der Literatur eine Reihe unterschiedlicher Endpunkte verwendet. In einigen Arbeiten werden alle Herz-Kreislauferkrankungen insgesamt betrachtet. Oftmals werden auch alle ischämischen Herzerkrankungen bzw. die zerebrovaskulären Erkrankungen gruppiert betrachtet. Andere Studien nutzen einzelne diagnostische Entitäten, z. B. den Herzinfarkt oder Bluthochdruck als zu untersuchende Zielerkrankung. Diese Heterogenität der Endpunkte ist beim Vergleich der Studien und ihrer Ergebnisse zu beachten.
5.2.3 Expositionen und Dosisbereiche im Überblick
Die Expositionen der in den vorliegenden Studien untersuchten Personen beruhten zumeist auf Gamma- und Röntgenstrahlung. Die für die beobachteten gesundheitlichen Auswirkungen relevanten Dosen reichen von kumulativen Ganzkörperdosen von etwa 100 mGy bei beruflich exponierten Kernkraftwerksmitarbeitern bis zu mittleren Werten für kumulative Organdosen bis zu 2,5 Gy im Rahmen einer Behandlung für Morbus Bechterew. Ähnlich hohe mittlere kardiovaskuläre Organdosen aufgrund diagnostischer Maßnahmen wurden in einer Studie bei Patienten mit Magengeschwüren, leicht niedrigere Dosen bei Skoliose-Patienten infolge häufiger Durchleuchtung registriert.
In der Analyse der Daten für die Majak-Arbeiter wurden Leberdosen als Surrogat für die nicht bekannten Herz- und Gefäßdosen verwendet. Effekte durch Gammastrahlung mit geringen Beiträgen durch Neutronenstrahlung wurden bei Majak-Arbeitern nach Expositionen im Bereich von einigen hundert Milligray beobachtet. Expositionen mit Plutonium waren schon bei geringeren Leberdosen relevant.
5.2.4 Risikoschätzungen und der Healthy-Worker-Effekt
In strahlenepidemiologischen Studien werden zumeist dosisbezogene Auswertungen durchgeführt. Dabei werden absolute und/oder relative Risiken per Dosis zumeist mittels linearer Regressionsmodelle geschätzt. Üblich ist in der Strahlenepidemiologie die Angaben des zusätzlichen absoluten (excess absolute risk EAR) und des zusätzlichen relativen Risikos (excess relative risk ERR) per Dosis, wobei häufig Risiken per 1 Gy oder 1 Sv sowie das zugehörige 90 %- oder 95 %-Konfidenzintervall geschätzt werden. Entsprechende Angaben zum dosisabhängigen Risiko kardiovaskulärer Erkrankungen wurden aus den identifizierten epidemiologischen Studien extrahiert.
Zu beachten ist insbesondere bei den Studien unter beruflich strahlenexponierten Personen, dass diese Personen oft im Vergleich zur Allgemeinbevölkerung eine niedrigere Sterblichkeit aufweisen, da es sich um eine positive Auswahl arbeitsfähiger Personen handelt, die zudem oft im Zusammenhang mit ihrer Arbeit gesundheitlich betreut oder überwacht werden. Dieser sogenannte Healthy Worker Effekt (HWE) ist bei Herz-Kreislauferkrankungen oft stärker ausgeprägt als bei Krebserkrankungen, da kardiovaskuläre Risikofaktoren bzw. vorbestehende kardiovaskuläre Erkrankungen oft auch eine Rolle bei der Auswahl für bzw. beim Verbleiben in einem Beruf spielen. Für dosisbezogene Auswertungen des Risikos, bei denen z. B. Kohortenmitglieder mit unterschiedlich hoher Strahlendosis verglichen werden, ist der HWE meist von geringerer Bedeutung, da hier keine Vergleiche mit der Allgemeinbevölkerung durchgeführt werden. Andere Aspekte des HWE, die etwa mit der Dauer der Beschäftigung bzw. der Expositionsdauer zusammenhängen, sind allerdings auch bei internen Auswertungen zu beachten, sodass z. B. für die Zeit seit Erstbeschäftigung oder die Länge des Follow-up statistisch kontrolliert werden muss.
5.3 Epidemiologische Studien
Tabelle 5.1 gibt eine Übersicht über die im Folgenden kurz erläuterten, für diesen Berichtsteil relevanten Studien. Wichtige Eckpunkte für die Gesamtbewertung werden zudem in den Tabellen 5.2 bis 5.4 tabellarisch zusammengefasst.
Tabelle 5.1: Übersicht über veröffentlichte und im Bericht verwendete epidemiologische Studien zu strahlenassoziierten Risiken für Herz-Kreislauferkrankungen (HKE).
Kohorte | Referenz | Wichtigste Endpunkte | Anzahl Mitglieder | Energiedosis (Gy), Spanne | Confounder (außer Geschlecht); Anmerkungen |
Atombombenüberlebende | Yamada (2004) | Inzidenz: | 10 339 | 0,1 (0 – 4) Dickdarmdosis | Rauchen, Alkohol |
Atombombenüberlebende AHS | Shimizu (2012) | Mortalität: Alle HKE Alle Herzerkrankungen | 86 611 | 0,1 (0 – 4) Dickdarmdosis | Rauchen, Alkohol, |
BNFL- | McGeoghegan (2008) | Mortalität: Alle HKE | 38 799 | 0,06 (0 – > 0,73) | Adjustierung für Beschäftigungsvariablen |
Majak- | Azizova (2011) | Inzidenz und Mortalität: | 18 763 | M: 0,66 (0 – 2,5) F: 0,52 (0 – 2,0) | Rauchen, Alkohol, Bluthochdruck, Body Mass Index |
Majak- | Azizova (2011a) | Inzidenz und Mortalität: | 18 763 | 0,66 (0 – 2,5) | Rauchen, Alkohol, Bluthochdruck, Body Mass Index |
Nuklearindustrie- | Vrijheid (2007) | Mortaliät: Ischämische Herzerkrankungen | 275 312 | 0,02 (0 – > 0,5) | Grobe Adjustierung für sozioökonomischen Status |
Semipalatinsk Historical Cohort | Grosche (2011) | Mortaliät: Alle HKE Ischämische Herzerkrankungen | 19 545 | 0,09 (k. A.) | – |
Tabelle 5.2: Übersicht über veröffentlichte und im Bericht verwendete epidemiologische Studien zu strahlenassoziierten Risiken für Herz-Kreislauferkrankungen (HKE) (Fortsetzung).
Kohorte | Referenz | Wichtigste Endpunkte | Anzahl Mitglieder | Energiedosis (Gy), Spanne | Confounder (außer Geschlecht); Anmerkungen | |||
Tuberkolose- | Davis (1989) | Mortaliät: Alle HKE | 13 385 | 0,84 (k. A.) Lungendosis | – | |||
Tschernobyl- | Ivanov (2006) | Inzidenz: Alle HKE | 61 017 | 0,11 (0 – > 0,5) | – | |||
UK- | Muirhead (2009) | Mortalität: Alle HKE | 174 541 | 0,025 (0 – > 0,4) | Adjustierung für | |||
Uranbergarbeiter | Kreuzer (2006) | Mortalität: Alle HKE | 59 001 | 0,04 (0 – > 0,3) | Adjustierung für Beschäftigungsvariablen | |||
5.3.1 Daten der Atombombenüberlebenden
Hinweise auf erhöhte kardiovaskuläre Risiken unter den Atombombenüberlebenden liegen schon seit längerer Zeit vor. Die aktuellste Analyse der LSS-Kohorte wurden im Jahr 2010 veröffentlicht (Shimizu et al. 2010). Daten der Jahre 1950 bis 2003 zur Mortalität unter 86 611 Überlebenden sowie Dosisdaten aus dem DS 02 standen zur Verfügung, für eine Untergruppe von ca. 36 500 Personen lagen zusätzlich Daten über andere Risiko- und soziodemografische Faktoren aus einem Survey im Jahr 1978 vor. Die Auswertung erfolgte mit einem linearen Modellansatz, andere Modelle wurden geprüft.
Die Autoren berichten von insgesamt 19 054 kardiovaskulären Todesfällen (ICD9 390-459) in der Beobachtungsperiode, davon 8 463 durch Herzerkrankungen,1 9 622 durch zerebrovaskuläre Erkrankungen (ICD9 430-438, von den Autoren mit „stroke“ bezeichnet) und 969 durch andere zirkulatorische Erkrankungen. Für alle kardiovaskulären Todesfälle gemeinsam errechnete sich ein zusätzliches relatives Risiko (ERR) je Dosis von 0,11 (95 %-KI2: 0,05; 0,17) Gy-1. Das ERR je Dosis für Herzerkrankungen lag etwas höher (0,14; 95 %-KI: 0,06; 0,23) Gy-1, dasjenige für zerebrovaskuläre Erkrankungen etwas niedriger (0,09; 95 %-KI: 0,01; 0,17) Gy-1. Todesfälle durch andere Kreislauferkrankungen waren nicht signifikant erhöht.
Im Bereich unter 0,5 Gy lag der Schätzer des ERR je Dosis für Herzerkrankungen bei 0,2 Gy-1, war aber aufgrund geringer Power nicht signifikant (95 %-KI: –0,05; 0,45). Es fanden sich keine Hinweise auf erhöhte Risiken für zerebrovaskuläre Erkrankungen unterhalb von 0,5 Gy.
Das zusätzliche absolute Risiko (EAR) je Dosis betrug für alle kardiovaskulären Todesfälle 5,5 (95 %-KI: 2,7; 8,4) (104PY Gy)-1. Das EAR je Dosis für Herzerkrankungen trug mit einem Wert von 3,2 (95 %-KI: 1,3; 5,2) (104PY Gy)-1 ca. drei Fünftel, dasjenige für zerebrovaskuläre Erkrankungen mit 2,3 (95 %-KI: 0,4; 4,4) (104PY Gy)-1 ca. zwei Fünftel zum Gesamtrisiko bei. Zu beachten ist, dass sich in Kohortenstudien zur Mortalität die spontane Mortalitätsrate und damit auch das absolute Risiko mit dem Lebensalter und dem Kalenderjahr verändert.
Für keine der untersuchten Todesursachen ergaben sich statistisch signifikante Hinweise auf Schwellendosen. Für Schlaganfall lag der beste Schätzwert für eine Schwellendosis bei 0,5 Gy mit einem 95 %-Konfidenzintervall von weniger als 0 Gy bis 2 Gy. Der beste Schätzwert einer Schwellendosis für Herzerkrankungen lag bei 0 Gy mit einer oberen Grenze des 95 %-Konfidenzintervalls bei 0,5 Gy.
Als Störfaktoren (Confounder) wurden sozioökonomische, lebensstilbezogene (Rauchen, Alkoholkonsum) und gesundheitliche Angaben in die Auswertungen einbezogen. Dies hatte jedoch so gut wie keinen Einfluss auf die Ergebnisse für das zusätzliche relative Risiko. Die Autoren betonen Unsicherheiten über den Verlauf der Dosis-Wirkungsbeziehung insbesondere für den Schlaganfall. Die neuen Daten werden jedoch als wesentlich aussagekräftiger als die früheren Auswertungen (z. B. Preston et al. 2003) eingeschätzt. Zusammenfassend belegt diese Studie ein gering erhöhtes, dosisabhängiges Herz-Kreislaufrisiko insbesondere für Herzerkrankungen und weniger deutlich für Schlaganfall unter den Überlebenden von Hiroshima und Nagasaki.
Als weitere Untersuchung unter Atombombenüberlebenden werden in der Adult Health Study kontinuierlich gesundheitsbezogene Daten einer Subkohorte der LSS erhoben. Somit liegen hier Morbiditätsdaten vor. Die aktuellste Veröffentlichung aus dem Jahr 2004 (Yamada et al. 2004) zeigt für ischämische Herzerkrankungen ein nicht signifikant erhöhtes ERR je Dosis von 0,05 (95 %-KI: –0,05; 0,16) Gy-1, für Bluthochdruck und Myokardinfarkt je nach Analyseansatz (lineares oder quadratisches Modell) signifikant positive ERR je Dosis mit Erhöhungen zwischen 0,03 und 0,17 Gy-1. Das ERR je Dosis für den Endpunkt ‚stroke II‘ (ICD9 430, 431, 433, 434, 436) betrug 0,07 (95 %-KI: –0,08; 0,24) Gy-1.
5.3.2 Patienten – Therapie und Diagnostik
Mehrere zum Teil ältere Studien quantifizieren das Herz-Kreislaufrisiko bei Patienten, die mit ionisierenden Strahlen für Nicht-Krebserkrankungen behandelt wurden und hierbei kumulative Dosen bis in den unteren Gray-Bereich erhielten.
Darby et al. (1987) untersuchten Patienten mit ankylosierender Spondylitis (Morbus Bechterew) in Großbritannien. Diese hatten im Rahmen der therapeutischen Bestrahlungen durchschnittliche Herzdosen in der Größenordnung 2,5 Gy erhalten (Spanne 0 bis ca. 17 Gy; unterschiedliche Anteile des Herzens exponiert). In dieser Studie fanden sich keine erhöhten Herz-Kreislauf-Mortalitätsrisiken. Für kardiovaskuläre Erkrankungen außer Schlaganfall lag das von Little et al. (Little et al. 2008) errechnete ERR je Dosis bei 0,01 Gy-1, für Schlaganfall bei –2,43 (95 %-KI: –4,29; 0,71) Gy-1.
In einer Kohortenstudie bei Magenulkus-Patienten in den USA, die in den Jahren 1936 bis 1965 mit Röntgenstrahlen (n = 1 859) bzw. auf andere Weise (n = 1 860) behandelt und bis 1997 nachverfolgt wurden, fanden sich insgesamt deutlich erhöhte Sterberisiken in der bestrahlten Gruppe im Vergleich mit Bevölkerungsdaten (Vergleich beobachteter mit erwarteten Fällen) (Carr et al. 2005). Bei den Bestrahlungen war jeweils nur ein kleiner Teil des Herzens (Apex ca. 5 %) direkt im Strahlenfeld; das übrige Herzgewebe erhielt aber Streustrahlung. Für koronare Herzkrankheiten zeigten die Autoren einen statistisch signifikanten Trend der relativen Risiken mit zunehmender Dosis. Dabei ergab sich eine ca. 50 %-Risikoerhöhung für die Patientengruppe mit den höchsten mittleren kardialen Dosen (3,9 Gy). Dieser Wert ist statistisch adjustiert für wichtige andere Einflussfaktoren. Keine Risikoerhöhung fand sich für zerebrovaskuläre Erkrankungen. Little et al. (2008) errechneten für diese Studie ein ERR je Dosis von 0,11 (95 %-KI: 0,01; 0,22) Gy-1 für koronare Herzerkrankungen. Andere kardiovaskuläre Erkrankungen wiesen keine positive Dosis-Wirkungsbeziehung auf. Für den im Strahlengang liegenden Anteil des Herzens wurden deutlich höhere Dosen abgeschätzt, sodass diese Studie nicht zur Evidenz für niedrige und mittlere Dosen beiträgt.
Tuberkulose-Patienten, die wiederholt durchleuchtet wurden und dabei über das Patientenkollektiv gemittelte Lungendosen von ca. 0,84 Gy erhielten (~ ungefähr Herzdosis, keine nähere Angabe zur Organexposition), wiesen in einer Kohortenstudie von Davis et al. (1989) keine Risikoerhöhungen für Herz-Kreislauferkrankungen auf. In der Kohorte von 13 385 Tbc-Patienten betrug das ERR je Dosis –0,11 (95 %-KI: –0,20; –0,01) Gy-1 (gemäß Little et al. 2008).
5.3.3 Beruflich exponierte Personen
Bei den bisher untersuchten beruflich exponierten Gruppen handelt es sich zumeist um medizinisches Personal, um Beschäftigte in der Nuklearindustrie und in der Atomwaffenproduktion (Gepoolte Daten, Arbeiter in Großbritannien, Majak-Arbeiter) bzw. um Uranbergarbeiter.
5.3.3.1 Medizinisches Personal
Medizinisches Personal mit beruflicher Strahlenexposition wurde in mehreren Kohortenstudien untersucht. Diese Studien weisen aber in der Regel eine sehr begrenzte Dosimetrie auf und nutzen Ersatzmaße, um eine Dosisabschätzung durchzuführen.
Hauptmann et al. (2003) berichten über die Kohorte medizinisch-technischer Radiologieassistenten aus den USA. In dieser großen Kohorte von 90 284 Personen fanden sich Hinweise auf erhöhte Risiken für kardiovaskuläre Sterblichkeit bei den Kohortenmitgliedern, die vor 1950 gearbeitet hatten, als der Strahlenschutz noch wenig entwickelt war. Das Risiko war um 42 % (95 %-KI: 4; 94 %) erhöht für die erste Beschäftigung als Radiologieassistent vor 1940 im Vergleich zur Erstbeschäftigung 1960 und später.
Radiologen in Großbritannien wiesen im Vergleich mit Nicht-Radiologen keine Risikoerhöhungen für Herz-Kreislauferkrankungen auf. In der Studie von Berrington et al. (2001) war das Risiko auch in verschiedenen Zeitperioden zwischen Radiologen und Nicht-Radiologen nicht unterschiedlich. Dagegen fanden sich Hinweise auf erhöhte Krebsrisiken in frühen Jahren des 20. Jahrhunderts, möglicherweise infolge erhöhter Strahlenexpositionen. Frühe Studien bei USamerikanischen Radiologen zeigten nicht signifikante Risikoerhöhungen auch für die Herz-Kreislaufsterblichkeit (Matanoski et al. 1975).
5.3.3.2 Internationale Studie von Beschäftigten in der Nuklearindustrie
Viele der großen Kohorten von Nuklearindustrie-Beschäftigten sind in der 15-Länder-Studie der International Agency for Research on Cancer (IARC) enthalten. (Vrijheid et al. 2007) veröffentlichten Ergebnisse zur Herz-Kreislaufmortalität in dieser Kohorte. Von 275 312 Kohortenmitgliedern lagen Daten zum sozioökonomischen Status vor, die in die Berechnungen mit eingingen. Für mehrere kardiovaskuläre Endpunkte fanden sich leichte, aber in keinem Fall signifikante Risikoerhöhungen bzw. positive Dosis-Wirkungsbeziehungen. Für alle kardiovaskulären Erkrankungen lag das ERR je Dosis bei 0,09 (95 %-KI: –0,43; 0,70) Gy-1.
5.3.3.3 Strahlenexponierte Arbeiter in Großbritannien
Eine neuere Auswertung der Kohorte von Arbeitern bei British Nuclear Fuels (BNFL-Kohorte; n = 64 937) aus Großbritannien für die Jahre 1946 bis 2005 (McGeoghegan et al. 2008) ergab ein signifikant positives ERR je Dosis von 0,65 (90 %-KI: 0,36; 0,98) Gy-1 für die Herz-Kreislaufmortalität. Für die zerebrovaskuläre Mortalität wurde ein ERR je Dosis von 0,43 (90 %-KI: –0,10; 1,12) Gy-1 errechnet. In der Interpretation der Studie ergeben sich allerdings Schwierigkeiten aufgrund der Inhomogenität der Effekte in verschiedenen Dosis- und Beschäftigungsgruppen.
Auch in der aktuellsten Auswertung der Daten des britischen Dosisregisters (Muirhead et al. 2009) ergeben sich Hinweise für erhöhte Herz-Kreislaufrisiken. Diese Studie umfasst 174 541 beruflich strahlenexponierte Personen und enthält einen Teil der Daten der BNFL-Kohorte. Das ermittelte ERR je Dosis für alle Herz-Kreislauferkrankungen beträgt 0,25 (95 %-KI: 0,01; 0,54) Gy-1. Damit liegt der Risikokoeffizient noch über den Daten aus der LSS, ist aber aufgrund des Konfidenzintervalls kompatibel mit den LSS-Ergebnissen. Hervorzuheben ist die Größe der hier untersuchten Kohorte; allerdings fehlen auch hier weitgehend Daten zu möglichen Störfaktoren.
5.3.3.4 Majak-Arbeiter
Die von Azizova et al. (Azizova et al. 2010a, Azizova et al. 2010b) analysierte Kohorte der Majak-Arbeiter schließt 12 210 Arbeiter ein, die in den Jahren 1948 bis 1958 in einem der drei Hauptwerke der Majak-Produktionsgenossenschaft (Atomkraftwerke, Radiochemisches Werk, Plutonium-Produktionsanlage) eingestellt wurden. Die Daten zu Mortalität und Inzidenz von zerebrovaskulären und kardiovaskulären Erkrankungen umfassten jeweils den Zeitraum von der Einstellung bis zur Diagnose der Krankheit, zum Tod bzw. zum Ende des Zeitintervalls, in dem noch aktuelle Information über den Arbeiter zur Verfügung stand (maximal 31. Dezember 2000).
Das Dosimetriesystem „Doses 2005“ für die Majak-Arbeiter beeinhaltet Komponenten zur Berechnung der jährlichen Organdosen durch externe Strahlung und durch inkorporiertes Plutonium (Vasilenko et al. 2007). Die externe Dosis durch Gammastrahlung mit für einige Arbeiter geringen Beiträgen von Neutronenstrahlung war für praktisch alle Arbeiter (99,9 %) bekannt. Die mittlere Dosis betrug für Männer 0,91 Gy (Standardabweichung, σ = 0,95 Gy) und für Frauen 0,65 Gy (σ = 0,75 Gy). Bei den Berechnungen des Risikos durch externe Strahlung wurde für Wirkungen von Plutonium Inkorporationen korrigiert. Für 30 % der Arbeiter, die potenziell mit Plutonium exponiert worden waren, lagen dafür Messungen der Plutoniumkonzentration im Urin und biokinetische Modelle vor, die auf umfangreichen Autopsiemessungen beruhten. Unter den Arbeitern mit Urinmessungen betrug die mittlere Leberdosis durch Plutonium 0,40 Gy (σ = 1,15 Gy) für Männer und 0,81 Gy (σ = 4,60 Gy) für Frauen. Für die anderen Arbeiter wurde eine Klasseneinteilung benutzt, die auf Grund von Art, Ort und Dauer der Tätigkeit vorgenommen wurde.
In der Kohorte wurden 3 751 Fälle von ischämischen Herzerkrankungen registriert, davon 683 akute myokardiale Infarkte. Todesursache waren für 1 495 Arbeiter ischämische Herzerkrankungen, davon für 338 Arbeiter akute myokardiale Infarkte. Ischämische Herzerkrankungen nahmen mit zunehmender externer Dosis zu (ERR je Dosis = 0,11 (95 %-KI: 0,05; 0,17) Gy-1). Im Dosisintervall 0,5 Gy-1 Gy war das Risiko im Vergleich zu Arbeitern mit Dosen kleiner 0,5 Gy nicht erhöht (relatives Risiko von 1,02 (95 %-KI: 0,92; 1,13). In Bezug auf die Mortalität an ischämischen Herzerkrankungen waren keine signifikanten Dosisabhängigkeiten zu beobachten, das ERR per Dosis lag bei 0,07 (95 %-KI: 0,02; 0,15) Gy-1.
In der Kohorte wurden 4 418 Fälle von zerebrovaskulären Erkrankungen gemeldet, davon 665 Schlaganfälle. Todesursache waren für 753 Arbeiter zerebrovaskuläre Erkrankungen, davon für 404 Arbeiter Schlaganfälle. Die Inzidenz zerebrovaskulärer Erkrankungen nahm sowohl mit zunehmender externer Dosis (ERR je Dosis = 0,46 (95 %-KI: 0,36; 0,57) Gy-1 als auch mit zunehmender Inkorporation von Plutonium (ERR je Leberdosis = 0,33 (95 %-KI: 0,17; 0,49) Gy-1 zu. Für Arbeiter mit externen Dosen im Bereich von 0,5 Gy – 1 Gy wurde im Vergleich zu Arbeitern mit Dosen kleiner 0,5 Gy ein relatives Risiko von 1,14 (95 %-KI: 1,04; 1,25) beobachtet. Auch für höhere Dosisgruppen war das Risiko erhöht. Für Arbeiter mit Leberdosen durch Inkorporation von Plutonium im Bereich von 0,1 Gy bis 0,5 Gy wurde im Vergleich zu Arbeitern mit Dosen kleiner als 0,1 Gy ein relatives Risiko von 1,23 (95 %-KI: 1,13; 1,35) beobachtet. Für höhere Dosisgruppen war das Risiko ebenfalls erhöht. Adjustierungen für andere Risikofaktoren als Strahlung (Bluthochdruck, Rauchen, Alkoholkonsum und Übergewicht) ergaben keine wesentlichen Veränderungen der Ergebnisse. Das Vorliegen von individuellen Informationen zu diesen Faktoren ist als eine Stärke dieser Untersuchung anzusehen.
Eine aktuelle Auswertung einer etwas vergrößerten Kohorte (18 763 Personen) mit Ende des Follow-up bis Ende 2005 ergab für die Inzidenz ischämischer Herzerkrankungen je nach analytischer Vorgehensweise ein ERR je Dosis zwischen 0,10 Gy-1 und 0,12 Gy-1 und somit einen nahezu unveränderten Wert im Vergleich zur früheren Analyse (Azizova et al. 2011a). Die Inzidenz war in der Dosisgruppe 0,2 Gy bis 0,5 Gy durch externe Strahlenexpositionen signifikant erniedrigt im Vergleich zur Dosisgruppe kleiner 0,2 Gy (RR = 0,90 [95 %-KI: 0,82; 0,98]).
In dieser vergrößerten Kohorte ergab sich für die Inzidenz zerebrovaskulärer Erkrankungen je nach analytischer Vorgehensweise ein ERR je Dosis zwischen 0,38 Gy-1 und 0,43 Gy-1 und somit ein nahezu unveränderter Wert im Vergleich zur früheren Analyse (Azizova et al. 2011b). Die Inzidenz war in der Dosisgruppe 0,2 Gy bis 0,5 Gy durch externe Strahlenexpositionen signifikant erhöht im Vergleich zur Dosisgruppe kleiner 0,2 Gy (RR = 1,12 [95 %-KI: 1,04; 1,22]).
Im Gegensatz zu den Daten für Erkrankungsraten ergaben die Daten für Sterblichkeit an zerebrovaskulären Erkrankungen im kürzeren wie längeren Follow-up insgesamt keine signifikanten Dosisabhängigkeiten. Analysen der Daten zum Schlaganfall ergaben weder für strahlenbedingte Erkrankungsraten noch für Sterblichkeit signifikante Ergebnisse. Die statistische Aussagekraft dieser Teilstudien ist wegen niedriger Fallzahlen gering.
5.3.3.5 Uranbergarbeiter
In einer Arbeit von Kreuzer et al. (Kreuzer et al. 2006) wird die Herz-Kreislaufmortalität der deutschen Uranbergarbeiter in der Wismut-Studie mit Follow-up bis Ende 1998 berichtet; eine Aktualisierung mit Follow-up bis Ende 2003 (Kreuzer et al. 2010) enthält im Gegensatz zu der älteren Veröffentlichung keine Daten zu Gamma-Strahlung. In die Auswertung gehen 59 001 Arbeiter ein, die gegenüber dem Alpha-Strahler Radon, langlebigen Alphastrahlern bzw. Gammastrahlung exponiert waren. Von den insgesamt 5 417 an kardiovaskulären Erkrankungen Verstorbenen waren 3 719 Todesfälle auf Herzerkrankungen (ICD10: 100-152) und 1 297 Todesfälle auf zerebrovaskuläre Erkrankungen zurückzuführen. Die statistischen Analysen ergaben keine Risikoerhöhungen in Abhängigkeit von der Exposition gegenüber Gammastrahlung. Das ERR je Dosis lag für die Herz-Kreislauferkrankungen bei –0,26 (95 %-KI: –0,6; 0,009) Gy-1, für Herzerkrankungen bei –0,35 (95 %-KI: –0,7; 0,009) Gy-1 und für zerebrovaskuläre Erkrankungen bei 0,09 (95 %-KI: –0,6; 0,8) Gy-1.
Lane et al. (2010) beschreiben die Sterblichkeit in der Kohorte von 17 660 Eldorado-Uranbergarbeitern mit Follow-up bis 1999. In Bezug auf Gammastrahlung ergeben sich ERR je Dosis von 0,15 Gy-1 für ischämische Herzerkrankungen. Für zerebrovaskuläre Erkrankungen lag das ERR je Dosis bei –0,29 Gy-1. Beide Werte waren nicht statistisch signifikant.
5.3.4 Durch den Tschernobyl-Unfall exponierte Personen
In der Folge des Tschernobyl-Unfalls wurden mehrere hunderttausend Personen vornehmlich aus dem Militär bei Aufräumarbeiten eingesetzt. Ivanov et al. untersuchten die Inzidenz an Herz-Kreislauferkrankungen in einer Kohorte von 61 017 russischen Liquidatoren (Ivanov et al. 2006). Für alle Herz-Kreislauferkrankungen insgesamt war das ERR je Dosis mit 0,18 (95 %-KI: –0,03; 0,39) Gy-1 statistisch nicht signifikant erhöht, für die Untergruppen ischämische Herzerkrankungen (ERR je Dosis = 0,41 Gy-1) und zerebrovaskuläre Erkrankungen (ERR je Dosis = 0,45 Gy-1) deutlich und signifikant höher. In dieser Kohorte sind die mittleren Dosen relativ niedrig, sie liegen um 100 mGy, allerdings sind die Dosisabschätzungen mit großen Unsicherheiten behaftet. Für die beobachteten Risikoerhöhungen können Confounder eine erhebliche Rolle spielen, diese konnten allerdings nicht erhoben werden. Das Risiko ist besonders für früh in der Unfallzone Arbeitende mit relativ hohen Dosen und Dosisraten erhöht.
5.3.5 Durch Atomwaffentests exponierte Personen
In einer Kohorte von 19 545 Bewohnern von Dörfern in Kasachstan, die gegenüber nuklearem Fall-out durch Atomwaffentests in Semipalatinsk exponiert waren bzw. als Kontrollregionen dienten, fanden Grosche et al. (2011) zwar insgesamt deutlich erhöhte kardiovaskuläre Mortalität bei exponierten Personen; diese war jedoch den Analysen zufolge klar auf die erhöhte Grundmortalität in exponierten Dörfern zurückzuführen. Allerdings lagen keine Informationen zu weiteren Herz-Kreislaufrisikofaktoren in der Kohorte vor. Das ERR je Dosis lag für alle Herz-Kreislauferkrankungen bei 0,02 Gy-1 (95 %-KI: –0,32; 0,37). Für ischämische Herzerkrankungen wurde ein ERR je Dosis von 0,06 (95 %-KI: –0,39; 0,52) Gy-1 ermittelt, und für Schlaganfall von –0,06 (95 %-KI: –0,65; 0,54) Gy-1.
5.3.6 Reviews und Meta-Analysen
UNSCEAR (2006) berichtet über kardiovaskuläre Erkrankungen und andere Nicht-Krebserkrankungen. Es wird generell festgestellt, dass Daten zu kardiovaskulären Erkrankungen in weitaus geringerem Umfang als zu Krebserkrankungen vorliegen und dass methodische Probleme unter anderem bei der Kontrolle von Störfaktoren die Interpretation der Daten erschweren. In die UNSCEAR-Bewertung gehen die in diesem Beitrag genannten Studien bis ca. 2005 ein. Der Schlussfolgerung des Komitees zufolge sind die bis 2005 vorliegenden Daten nicht ausreichend, um eine kausale Beziehung zwischen ionisierender Strahlung und kardiovaskulären Erkrankungen im Dosisbereich unter 1 Gy bis 2 Gy zu belegen. Zudem wird auf das Fehlen eines plausiblen biologischen Mechanismus hingewiesen.
Hoel (2006) fasst epidemiologische Studien unter beruflich strahlenexponierten Personen sowie die Ergebnisse zu kardiovaskulären Endpunkten aus den Studien bei Atombombenüberlebenden zusammen. Die Evidenz für erhöhte kardiovaskuläre Risiken ab Dosen über 0,5 Gy wird als recht gut eingeschätzt und verschiedene mögliche Mechanismen werden erörtert.
McGale und Darby (2005; 2008) fokussieren in ihrer Übersicht auf Ergebnisse aus randomisierten Brustkrebs-Therapiestudien, bei denen kardiale Dosen zwischen 1 Gy bis 20 Gy auftraten und eine 27 %-ige Risikoerhöhung für kardiovaskuläre Mortalität bei radiotherapierten Patientinnen gegenüber Patientinnen ohne Radiotherapie beobachtet wurden (Mc Gale und Darby 2005). Die systematische Übersicht der Autoren zum Herz-Kreislaufrisiko nach Exposition mit ionisierenden Strahlen ergibt ein nicht konsistentes Bild, bei dem sich positive, negative und Studien mit einem Null-Resultat in etwa die Waage halten.
In einem aktuellen Review von 2009 ermitteln Little et al. (2010) mit meta-analytischen Methoden zusammengefasste Risikoschätzer (ERR/Dosis) für kardiovaskuläre Erkrankungen aus vorliegenden Studien mit niedrigen bis mittleren Dosen. Daten der LSS werden hierbei eingeschlossen. Die Autoren weisen ausdrücklich auf die große Heterogenität der Studien sowie auf die vielfältigen Verzerrungsmöglichkeiten in Studien zu kardiovaskulären Endpunkten hin. Die Heterogenität wird nicht wesentlich geringer, wenn nur Studien mit vergleichbaren Endpunkten gemeinsam ausgewertet werden. Das errechnete ERR je Dosis für alle kardiovaskulären Erkrankungen variiert je nach eingeschlossenen Studien zwischen 0,03 (95 %-KI: 0,00; 0,07) Gy-1 und 0,19 (95 %-KI: 0,14; 0,24) Gy-1 und ist bei der getrennten Betrachtung des Endpunktes Schlaganfall am höchsten (ERR je Dosis = 0,27 (95 %-KI: 0,20; 0,34) Gy-1). Ähnliche Ergebnisse finden sich in weiteren neueren Arbeiten des Autors (Little et al. 2008, Little 2009).
5.4 Limitationen der vorliegenden Studien
Auf die wesentlichen Einschränkungen der einzelnen Studien wurde jeweils hingewiesen. Festzuhalten ist, dass nur in wenigen Untersuchungen, darunter die Studien bei Atombombenüberlebenden, Ulkus-Patienten und den Majak-Arbeitern, ausreichende Daten zu wichtigen kardiovaskulären Risikofaktoren vorliegen, die für die Risikobeurteilung bezüglich ionisierender Strahlung bedeutsam sind. In einigen Studien konnte zumindest der sozioökonomische Status einbezogen werden.
Nur in wenigen der epidemiologischen Studien konnten Dosiswerte für Organe verwendet werden, die für Herz-Kreislauferkrankungen relevant sind. Insofern sind die Dosisschätzungen zumeist mit erheblichen Unsicherheiten behaftet. In verschiedenen Expositionssituationen kam es zudem zu Inkorporationen, die nicht immer angemessen berücksichtigt werden konnten oder als vernachlässigbar eingestuft wurden. Für die Kohorte der Majak-Arbeiter wurden größere Anstrengungen unternommen, die Plutoniumexposition zu quantifizieren und in die Dosisschätzung aufzunehmen.
5.5 Zusammenfassung und Bewertung
Im Folgenden werden zur Risikobewertung Ergebnisse für Gruppen kardiovaskulärer Erkrankungen zusammengefasst, zu denen eine größere Anzahl der vorliegenden Studien detaillierte Risikoschätzungen enthält. Entsprechend werden neben allen Herz-Kreislauferkrankungen (ICD9 390-459; ICD10 100-199) die ischämischen Herzerkrankungen (ICD9 410-414; ICD10 120-125), die den Myokardinfarkt einschließen, und die zerebrovaskulären Erkrankungen (ICD9 430-438; ICD10 160-169), die den Schlaganfall einschließen, zur Gesamtbewertung herangezogen.
Der abschließende Abschnitt geht auf Abschätzungen von Risiken nach Expositionen mit Niedrig-LET-Strahlung mit Energiedosen im Bereich von einigen hundert Milligray ein.
5.5.1 Herz-Kreislauferkrankungen
Die aktuelle Arbeit von Shimizu et al. (2010) für die Atombombenüberlebenden ergab ein ERR je Dosis von 0,11 (95 %-KI: 0,05; 017) Gy-1. Mit drei Ausnahmen sind die anderen Studien damit konsistent (Tabelle 5.2). Eine Studie ergibt ein höheres Risiko (BNFL-Arbeiter), zwei Studien ergeben ein niedrigeres Risiko (Tuberkulose-Patienten, Uranbergarbeiter).
Insgesamt geben die Analysen mit linearen Dosis-Wirkungsbeziehungen Hinweise, dass das ERR je Dosis für Herz-Kreislauferkrankungen um einen Faktor 3 bis 5 geringer ist als für Krebserkrankungen.
Tabelle 5.3: Ergebnisse für das ERR je Dosis in der Analyse von Daten zu Herz-Kreislauferkrankungen mit dem linearen Dosis-Wirkungsmodell.
Kohorte | Referenz | Endpunkt | ERR je Dosis (Gy- |
Atombombenüberlebende, LSS | Shimizu (2010) | Mortalität | 0,11 (95 %- |
BNFL- | McGeoghegan (2008) | Mortalität | 0,65 (90 %- |
Nuklearindustrie- | Vrijheid (2007) | Mortalität | 0,09 (95 %- |
Semipalatinsk Historical Cohort | Grosche (2011) | Mortalität | 0,02 (95 %- |
Tschernobyl- | Ivanov (2006) | Inzidenz | 0,18 (95 %- |
Tuberkulose- | Davis (1989) Little (2008) | Mortalität | –0,11 (95 %- |
UK- | Muirhead (2009) | Mortalität | 0,25 (95 %- |
Uranbergarbeiter | Kreuzer (2006) | Mortalität | –0,26 (95 %- |
5.5.2 Ischämische Herzerkrankungen
Die Ergebnisse der Analysen von acht der zehn vorliegenden Studien mit dem Modell eines zusätzlichen relativen Risikos (ERR), das linear von der Dosis abhängt, sind konsistent mit Werten des ERR je Dosis im Bereich von 0,06 Gy-1 bis 0,14 Gy-1 (Tabelle 5.3). Eine Studie ergab einen höheren Risikowert (BNFL-Arbeiter), eine Studie einen niedrigeren Wert (Uranbergarbeiter). Der genannte Wertebereich ist konsistent mit den im Abschnitt 5.5.1 genannten Abschätzungen für alle Herz-Kreislauferkrankungen.
Tabelle 5.4: Ergebnisse für das ERR je Dosis in der Analyse von Daten zu ischämischen Herzerkrankungen mit dem linearen Dosis-Wirkungsmodell.
Kohorte | Referenz | Endpunkt | ERR je Dosis (Gy- |
Atombombenüberlebende, AHS | Yamada (2004) | Inzidenz | 0,05 (95 %- |
Atombombenüberlebende, LSS | Shimizu (2010) | Mortalität | 0,14 (95 %- |
BNFL- | McGeoghegan (2008) | Mortalität | 0,70 (90 %- |
Majak- | Azizova (2011) | Inzidenz | 0,10 (95 %- |
Majak- | Azizova (2011) | Mortalität | 0,06 (95 %- |
Nuklearindustrie- | Vrijheid (2007) | Mortalität | –0,01 (95 %- |
Semipalatinsk Historical Cohort | Grosche (2011) | Mortalität | 0,06 (95 %- |
Tschernobyl- | Ivanov (2006) | Inzidenz | 0,41 (95 %- |
UK- | Muirhead (2009) | Mortalität | 0,26 (95 %- |
Uranbergarbeiter | Kreuzer (2006) | Mortalität | –0,35 (95 %- |
|
- *
- Ergebnis für alle Herzerkrankungen, da die Klassifikation nach Untertypen unzuverlässig ist (Shimizu) bzw. keine Ergebnisse für ischämische Herzerkrankungen publiziert wurden (Kreuzer).** Ergebnis für „coronary heart disease“ (ICD9 414).
5.5.3 Zerebrovaskuläre Erkrankungen
Die Ergebnisse der Analysen von acht der zehn vorliegenden Studien mit dem Modell eines zusätzlichen relativen Risikos (ERR), das linear von der Dosis abhängt, sind konsistent mit Werten des ERR je Dosis im Bereich von 0,11 Gy-1 bis 0,17 Gy-1 (Tabelle 5.4). Die Risikoergebnisse für die Inzidenzdaten der Majak-Arbeiter sind nicht mit diesem Risikobereich konsistent (untere Grenze des Konfidenzbereichs bei 0,32 Gy-1). Allerdings ist das Ergebnis der Auswertung der Inzidenzdaten der Majak-Arbeiter auch nicht konsistent mit dem ERR je Dosis für die Mortalitätsdaten (obere Grenze des Konfidenzintervals bei 0,12 Gy-1). Das Ergebnis für die Inzidenz ist wegen der größeren Fallzahl (7 266 vs. 1 494) und wegen der besseren Datenqualität höher zu bewerten als das Ergebnis für die Mortalität.
Der genannte Wertebereich ist konsistent mit den im Abschnitt 5.5.1 genannten Abschätzungen für alle Herz-Kreislauferkrankungen.
Tabelle 5.5: Ergebnisse für das ERR je Dosis in der Analyse von Daten zu zerebrovaskulären Erkrankungen mit dem linearen Dosis-Wirkungsmodell.
Kohorte | Referenz | Endpunkt | ERR je Dosis (Gy- |
Atombombenüberlebende, AHS | Yamada (2004) | Inzidenz | 0,07 (95 %- |
Atombombenüberlebende, LSS | Shimizu (2010) | Mortalität | 0,09 (95 %- |
BNFL- | McGeoghegan (2008) | Mortalität | 0,43 (90 %- |
Majak- | Azizova (2011a) | Inzidenz | 0,41 (95 %- |
Majak- | Azizova (2011a) | Mortalität | 0,03 (95 %- |
Nuklearindustrie- | Vrijheid (2007) | Mortalität | 0,88 (95 %- |
Semipalatinsk Historical Cohort | Grosche (2011) | Mortalität | –0,06 (95 %- |
Tschernobyl- | Ivanov (2006) | Inzidenz | 0,45 (95 %- |
UK- | Muirhead (2009) | Mortalität | 0,16 (95 %- |
Uranbergarbeiter | Kreuzer (2006) | Mortalität | 0,09 (95 %- |
- *
- Für den Endpunkt „stroke II“ (ICD9 430, 431, 433, 434, 436).
5.5.4 Dosis-Wirkungsbeziehung unterhalb von 500 mGy
Für die Atombombenüberlebenden von Hiroshima und Nagasaki ergaben Untersuchungen der Dosis-Wirkungsbeziehung für Herzerkrankungen keinen Hinweis auf eine Nichtlinearität (Shimizu et al. 2010). Der beste Schätzwert einer Schwellendosis lag bei 0 Gy mit einer oberen Grenze des 95 %-Konfidenzintervalls bei 0,5 Gy. Für zerebrovaskuläre Erkrankungen war das ERR im Niedrigdosisbereich niedriger als der Wert in einer Analyse der Daten für die gesamte Kohorte mit einer linearen Dosis-Wirkungsbeziehung. Der beste Schätzwert für eine Schwellendosis lag bei 0,5 Gy mit einem 95 %-Konfidenzintervall von nicht mehr als 0 Gy bis 2 Gy.
Schöllnberger et al. (2012) führten eine Analyse der LSS-Daten mit der Multi-Modell-Methode durch. Dabei werden die Risikowerte, die sich aus mehreren Modellen ergeben, entsprechend ihrer Fitqualität gewichtet. Es ergab sich, dass das ERR für zerebrovaskuläre Erkrankungen bei einer Dosis von 400 mGy um einen Faktor 3,3 geringer ist als das Ergebnis der Analyse mit einer linearen Dosis-Wirkungsbeziehung (Abbildung 5.1). Das 90 %-Konfidenzintervall für das ERR bei 400 mGy reicht von 0 (kein zusätzliches Risiko) bis 0,07. Modelle mit einer Schwelle oberhalb von 400 mGy hatten ein Gewicht von 55 %, d. h. dass Modelle mit einer Schwelle in der Dosis-Wirkungsbeziehung und Modelle ohne Schwelle die Daten vergleichbar gut beschrieben.
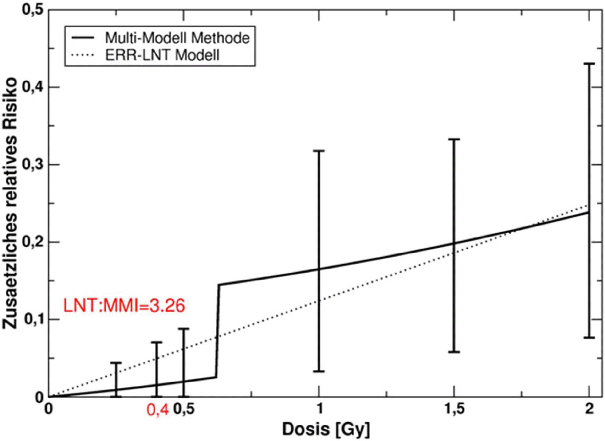
Abbildung 5.1: Analyse der LSS-Daten zu zerebrovaskulären Erkrankungen mit der Multi-Modell-Methode (nach Schöllnberger et al. 2012). Nach dieser Analyse ist das ERR bei 400 mGy um einen Faktor 3,3 niedriger als das Ergebnis der Analyse mit einer linearen Dosis-Wirkungsbeziehung. Das 90 %-Konfidenzintervall für das ERR bei 400 mGy reicht von 0 (kein zusätzliches Risiko) bis 0,07.
In der Multi-Modell-Analyse von Schöllnberger et al. (2012) war das EAR für kardiovaskuläre Erkrankungen außer zerebrovaskulären Erkrankungen bei 400 mGy um einen Faktor 2,4 niedriger als das Ergebnis der Analyse mit einer linearen Dosis-Wirkungsbeziehung (Abbildung 5.2). Das 90 %-Konfidenzintervall für das EAR bei 400 mGy reicht von 0 (kein zusätzliches Risiko) bis zu 5 Fällen je 10 000 Personenjahren. Modelle mit einer Schwelle oberhalb von 400 mGy hatten ein Gewicht von 33 %, d. h. dass Modelle ohne eine Schwelle in der Dosis-Wirkungsbeziehung die Daten zwar besser beschrieben als Modelle mit einer Schwelle, Letztere aber nicht ausgeschlossen werden können.
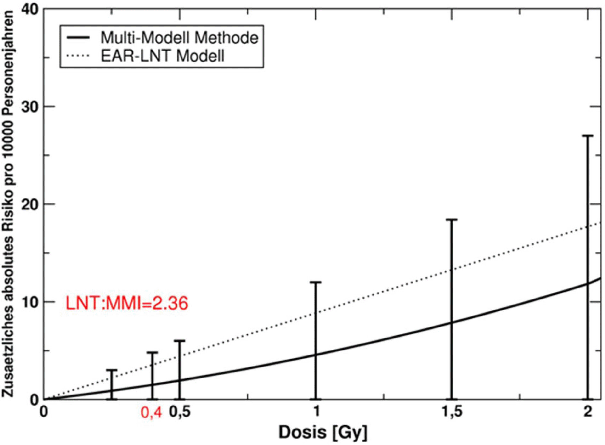
Abbildung 5.2: Analyse der LSS-Daten zu kardiovaskulären Erkrankungen außer zerebrovaskulären Erkrankungen mit der Multi-Modell-Methode (nach Schöllnberger et al. 2012). Nach dieser Analyse ist das EAR bei 400 mGy um einen Faktor 2,4 niedriger als das Ergebnis der Analyse mit einer linearen Dosis-Wirkungsbeziehung. Das 90 %-Konfidenzintervall für das EAR bei 400 mGy reicht von 0 (kein zusätzliches Risiko) bis zu 5 Fällen je 10 000 Personenjahren.
Die Studie der BNFL-Arbeiter (McGeoghegan et al. 2008) ergab einen sehr hohen Wert für das ERR je Dosis. Das Verhältnis der beobachteten zu den erwarten Sterbefällen an Herz-Kreislauferkrankungen lag in den beiden höchsten Dosisgruppen (> 400 mGy und von 200 mGy bis 400 mGy) konsistent bei 1,3, variierte im Bereich von 10 mGy bis 200 mGy im Bereich von 1,02 bis 1,17 und lag bei Dosen unterhalb von 10 mGy bei 0,96. Die Autoren weisen allerdings darauf hin, dass Schlussfolgerungen aus der Studie nur mit Vorsicht gezogen werden können, da Teilgruppen der Kohorte unterschiedliche Ergebnisse gaben (p-Wert für Inhomogenität: 0,016).
Während in der Analyse der Inzidenz von Herzerkrankungen unter den Majak-Arbeitern (Azizova et al. 2011a) das Risiko in der Dosisgruppe von 200 bis 500 mGy im Vergleich zur Dosisgruppe kleiner 200 mGy signifikant erniedrigt war, war es für zerebrovaskuläre Erkrankungen (Azizova et al. 2011b) signifikant erhöht.
Für die weitaus überwiegende Mehrheit (99,9 %) der Arbeiter in der Internationalen Studie von Beschäftigten in der Nuklearindustrie (Vrijheid et al. 2007) war die kumulative Dosis kleiner als 500 mGy. Allerdings haben die Ergebnisse der Studie für Herz-Kreislauferkrankungen eine sehr große Unsicherheit, sodass sich keine Schlüsse auf die Strahlenwirkung unterhalb von 500 mGy ergeben.
Die Studie der Semipalatinsk Historical Cohort (Grosche et al. 2011) hat insgesamt eine geringe statistische Aussagekraft. Für die einzelnen Dosiskategorien ergeben sich keine statistisch signifikanten Aussagen.
In der Studie der Tuberkulose-Patienten (Davis et al. 1989) waren 4 611 nicht strahlenexponiert, 1 881 hatten Lungendosen kleiner als 500 mGy und 2 416 Lungendosen größer als 500 mGy. Der statistisch signifikant negative Koeffizient in der linearen Dosis-Wirkungsbeziehung (Little et al. 2008) ist wohl eher den Patienten mit Lungendosen größer als 500 mGy zuzuschreiben als denjenigen mit niedrigen Dosen.
In der Studie der Tschernobyl-Aufräumarbeiter wurde das relative Risiko zerebrovaskulärer Erkrankungen in 9 Dosisgruppen mit jeweils ca. 3 000 Arbeitern, die im ersten Jahr nach dem Tschernobyl-Unfall zum Einsatz kamen, relativ zu den 3 000 Arbeitern in der niedrigsten Dosisgruppe (Energiedosis kleiner als 50 mGy) berechnet. Während in der obersten Dosisgruppe (Mittelwert 265 mGy) keine Risikoerhöhung beobachtet wurde, lagen die besten Schätzwerte des relativen Risikos in den vier nächsthöchsten Dosisgruppen (Mittelwerte von 190 mGy bis 230 mGy) im Bereich von 1,05 bis 1,12. Insgesamt waren die ERR-je-Dosis-Werte der Arbeiter, die später zum Einsatz kamen, geringer. Die Studie gibt Hinweise darauf, dass das zusätzliche Risiko je Dosis mit der Dosisrate steigt.
In der Studie der im UK-Strahlenregister registrierten Personen (Muirhead et al. 2009) wird die Gruppe mit Dosen oberhalb von 100 mGy nicht weiter aufgeteilt. Es lassen sich also keine Schlussfolgerungen über Wirkungen von Strahlenexpositionen mit Dosen oberhalb und unterhalb von 500 mGy ziehen.
Unter den 59 001 Uranbergarbeitern in der Studie von Kreuzer et al. (2006) hatten 6 638 Arbeiter eine externe Gammastrahlendosis im Bereich von 100 mGy bis 500 mGy und 124 eine Dosis von mehr als 500 mGy. Für Arbeiter mit Dosen von mehr als 300 mGy ergab sich im Vergleich zu den Nichtexponierten ein signifikant negativer Wert des relativen Risikos. In der Dosisgruppe 100 mGy bis 300 mGy ergab sich trotz der größeren statistischen Power und der damit verbundenen geringeren Breite des Konfidenzintervalls kein statistisch signifikantes Ergebnis.
Insgesamt überwiegt die Tendenz zu einer Risikoerhöhung von Herz-Kreislauferkrankungen nach Strahlenexpositionen im Bereich von einigen hundert Milligray. Analysen mit einer linearen Dosis-Wirkungsbeziehung ergeben ein ERR je Dosis von ca. 0,1 Gy-1. Allerdings ergeben unterschiedliche Studien widersprüchliche Evidenz für oder gegen einen niedrigeren Wert des ERR je Dosis oder einer Schwelle im Bereich von Dosen unterhalb von 500 mGy.
5.5.5 Risikoabschätzung für eine Exposition mit 400 mGy
Nach wie vor bestehen große Unsicherheiten über mögliche Risiken von Herz-Kreislauferkrankungen nach Strahlenexpositionen mit einer Energiedosis von einigen hundert Milligray. Dennoch erlauben die obigen Betrachtungen eine erste grobe Abschätzung möglicher Risiken von Herz-Kreislauferkrankungen nach einer Exposition mit Niedrig-LET-Strahlung mit einer Energiedosis von 400 mGy. Den Ausgangspunkt bilden hierbei zunächst Analysen der vorliegenden Daten mit der linearen Dosis-Wirkungsbeziehung. In diesen Analysen ergeben die Studien strahlenexponierter Arbeiter Werte des ERR je Dosis für Herz-Kreislauferkrankungen, die konsistent mit dem Ergebnis von Shimizu et al. (2010) für die Atombombenüberlebenden von Hiroshima und Nagasaki sind. Es liegt somit keine Evidenz vor, dass sich in diesem Dosisbereich die zusätzlichen Risiken nach längerfristigen Expositionen von denen nach akuten Expositionen unterscheiden.
Die besten Schätzwerte des ERR je Dosis in den einzelnen Studien strahlenexponierter Arbeiter haben große statistische Unsicherheiten. Als Ausgangspunkt für die weiteren Überlegungen wird deshalb das Ergebnis der Studie für die Atombombenüberlebenden (Shimizu et al. 2010) mit einem besten Schätzwert des ERR je Dosis von 0,11 Gy-1 gewählt. Bezüglich der Form der Dosis-Wirkungsbeziehung im Bereich moderater Dosen gibt es sowohl für akute wie für längerfristige Expositionen vergleichbar viel Evidenz für eine lineare Dosis-Wirkungsbeziehung wie für geringere Strahlenwirkungen oder gar eine Schwelle im Bereich niedriger moderater Dosen. Der gegenwärtige Kenntnisstand deutet somit für den Bereich von einigen hundert Milligray wegen der möglichen Nichtlinearität der Dosis-Wirkungsbeziehung auf Risikowerte hin, die niedriger sind, als es sich mit dem oben genannten Wert für das ERR je Dosis ergeben würde. Eine Analyse der LSS-Daten mit der Multi-Modell-Methode ergab, dass das ERR für Herz-Kreislauferkrankungen bei 400 mGy um einen Faktor 3 geringer ist als das Ergebnis der Analyse mit der linearen Dosis-Wirkungsbeziehung. Damit wäre das ERR für Herz-Kreislauferkrankungen bei 400 mGy um eine Größenordnung kleiner als das ERR für Krebs. Da die Spontanrisiken für Herz-Kreislauferkrankungen höher sind als für Krebserkrankungen, sind die Unterschiede der zusätzlichen absoluten Risiken geringer als die Unterschiede der zusätzlichen relativen Risiken.
Der Vergleich deutet darauf hin, dass absolute Risiken für Herz-Kreislauferkrankungen nach Strahlenexposition mit einer Dosis von einigen hundert Milligray geringer sind als die entsprechenden Krebsrisiken, aber dennoch nicht vernachlässigt werden sollten. Die Hinweise auf mögliche Risikoerhöhungen für Herz-Kreislauferkrankungen nach Strahlenexpositionen mit einer Dosis von einigen hundert Milligray sollten aber, obwohl ein Nullrisiko nicht ausgeschlossen werden kann, aus Vorsorgegründen bei der Erarbeitung von gesetzlichen Regelungen berücksichtigt werden.
5.6 Literaturverzeichnis
AGIR 2010 | Independent Advisory Group on Ionising Radiation. Circulatory Disease Risk. Documents of the Health protection Agency. Radiation, Chemical and Environmental Hazards. 2010; RCE- |
Azizova et al. 2010a | Azizova TV, Muirhead CR, Druzhinina MB et al. Cardiovascular diseases in the cohort of workers first employed at Mayak PA in 1948 – 1958. Rad Res. 2010;174(2): 155 – 168 |
Azizova et al. 2010b | AzizovaTV, Muirhead CR, Druzhinina MB et al. (2010b). Cerebrovascular diseases in the cohort of workers first employed at Mayak PA in 1948 – 1958. Radiat Res. 2010;174 (6): 851 – 864 |
Azizova et al. 2011a | Azizova TV, Muirhead CR, Mooseva MB et al. Ischemic heart diseases in nuclear workers first employed at the Mayak PA in 1948 – 1972. Health Phys. 2011; (accepted) |
Azizova et al. 2011b | Azizova TV, Muirhead CR, Mooseva MB et al. Cerebrovascular diseases in nuclear workers first employed at the Mayak PA in 1948 – 1972. Radiat Environ Biophys. 2011;50:539 – 552 |
BEIR VII | BEIR VII. Health Risks from Exposure to Low Levels of Ionizing Radiation. BEIR VII Phase 2. National research Council. The national Academies press, Washington, DC. 2006 |
Berrington et al. 2001 | Berrington A, Darby SC, Weiss HA, Doll R. 100 years of observation on British radiologists: mortality from cancer and other causes 1897 – 1997. Br J Radiol. 2001;74(882):507 – 519 |
Carr et al. 2005 | Carr ZA, Land CE, Kleinerman RA et al. Coronary heart disease after radiotherapy for peptic ulcer disease. Int J Radiat Oncol Biol Phys. 2005;61(3):842 – 850 |
Darby 1987 | Darby SC, Doll R, Gill SK, Smith PG. Long term mortality after a single treatment course with X- |
Davis et al. 1989 | Davis FG, Boice JD, Jr., Hrubec Z, Monson RR. Cancer mortality in a radiation- |
Grosche et al. 2011 | Grosche B, Lackland DT, Land CE et al. Mortality from cardiovascular diseases in the Semipalatinsk historical cohort, 1960 – 1999, and its relationship to radiation exposure. Radiat Res. 2011;176:660 – 669 |
Hauptmann et al. 2003 | Hauptmann M, Mohan AK, Doody MM, Linet MS, Mabuchi K. Mortality from diseases of the circulatory system in radiologic technologists in the United States. Am J Epidemiol. 2003; 157(3):239 – 248 |
Hoel 2006 | Hoel DG. Ionizing radiation and cardiovascular disease. Ann NY Acad Sci. 2006;1076: 309 – 317 |
Ivanov et al. 2006 | Ivanov VK, Maksioutov MA, Chekin SY et al. The risk of radiation- |
Kreuzer et al. 2006 | Kreuzer M, Kreisheimer M, Kandel M, Schnelzer M, Tschense A, Grosche B. Mortality from cardiovascular diseases in the German uranium miners cohort study, 1946 – 1998. Radiat Environ Biophys. 2006;45(3):159 – 166 |
Kreuzer et al. 2010 | Kreuzer M, Grosche B, Schnelzer M, Tschense A, Dufey F, Walsh L. Radon and risk of death from cancer and cardiovascular diseases in the German uranium miners cohort study: followup 1946 – 2003. Radiat Environ Biophys. 2010; 49(2):177 – 185 |
Lane et al. 2010 | Lane RSD, Frost SE, Howe GR, Zablotska LB. Mortality (1950 – 1999) and Cancer Incidence (1969 – 1999) in the Cohort of Eldorado Uranium Workers. Radiation Research. 2010; 174:773 – 785 |
Little et al. 2008 | Little M P, Tawn E J, Tzoulaki I et al. A systematic review of epidemiological associations between low and moderate doses of ionizing radiation and late cardiovascular effects, and their possible mechanisms. Radiat Res. 2008;169(1):99 – 109 |
Little 2009 | Little M P. Cancer and non- |
Little et al. 2010 | Little MP, Tawn EJ, Tzoulaki I et al. Review and meta- |
Matanoski et al. 1975 | Matanoski GM, Seltser R, Sartwell PE, Diamond EL, Elliott EA. The current mortality rates of radiologists and other physician specialists: deaths from all causes and from cancer. Am J Epidemiol. 1975;101(3):188 – 198 |
McGale und Darby 2005 | McGale P, Darby SC. Low doses of ionizing radiation and circulatory diseases: a systematic review of the published epidemiological evidence. Radiat Res. 2005;163(3):247 – 257 |
McGale und Darby 2008 | McGale P, Darby SC (2008). Commentary: A dose- |
McGeoghegan et al. 2008 | McGeoghegan D, Binks K, Gillies M, Jones S, Whaley S. The non- |
Muirhead et al. 2009 | Muirhead CR, O’Hagan JA, Haylock RG et al. Mortality and cancer incidence following occupational radiation exposure: third analysis of the National Registry for Radiation Workers. Br J Cancer. 2009;100(1):206 – 212 |
Preston et al. 2003 | Preston DL, Shimizu Y, Pierce DA, Suyama A, Mabuchi K. Studies of Mortality of Atomic Bomb Survivors. Report 13: Solid cancer and Noncancer Disease Mortality: 1950 – 1997. Rad Research. 2003;160:381 – 407 |
Schöllnberger et al. 2012 | Schöllnberger H, Kaiser JC, Walsh L, Jacob P. Dose- |
Shimizu et al. 2010 | Shimizu Y, Kodama K, Nishi N et al. (2010). Radiation exposure and circulatory disease risk: Hiroshima and Nagasaki atomic bomb survivor data, 1950 – 2003. BMJ. 2010;340:b5349. doi:10.1136/bmj.b5349.:b5349 |
UNSCEAR 2008 | United Nations Scientific Committee on the Effects of Atomic Radiation. Effects of ionizing radiation UNSCEAR 2006 report. New York: United Nations. 2008 |
Vasilenko et al. 2007 | Vasilenko EK, Khokhryakov VF, Miller SC, Fix JJ, Eckerman K, Choe DO, Gorelov M, Khokhryakov VV, Knyasev V, Krahenbuhl MP, Scherpelz RI, Smetanin M, Suslova K, Vostrotin V. Mayak worker dosimetry study: An overview. Health Phys. 2007;93(3):190 – 206 |
Vrijheid et al. 2007 | Vrijheid M, Cardis E, Ashmore P et al. Mortality from diseases other than cancer following low doses of ionizing radiation: results from the 15- |
Yamada et al. 2004 | Yamada M, Wong FL, Fujiwara S, Akahoshi M, Suzuki G. Noncancer disease incidence in atomic bomb survivors, 1958 – 1998. Radiat Res. 2004;161(6):622 – 632 |
6 Evidenz eines Zusammenhangs von Herz-Kreislauferkrankungen mit vorangegangenen Expositionen ionisierender Strahlung mit einer Energiedosis von einigen hundert Milligray
Eine zusammenfassende Bewertung der Evidenz eines Zusammenhangs von Herz-Kreislauferkrankungen mit vorangegangenen Expositionen ionisierender Strahlung mit einer Energiedosis von einigen hundert Milligray ist in Tabelle 6.1 dargestellt.
Tabelle 6.1: Evidenz eines Zusammenhangs von Herz-Kreislauferkrankungen mit vorangegangenen Expositionen ionisierender Strahlung mit einer Energiedosis von einigen hundert Milligray.
Bewertungskriterium | Evidenz |
Physikalisch- | Ionisierende Strahlung erzeugt Schäden an der DNA und oxidativen Stress. Der Zusammenhang mit Herz- |
Biologisches Wirkmodell | Ionisierende Strahlung erzeugt Zelltod, genomische Instabilität und beeinflusst die interzelluläre Kommunikation. Der Zusammenhang mit Herz- |
Dosis- | Für die physikalisch- |
In- | Es gibt hinreichend Evidenz in in- |
In- | Die Evidenz für Strahleneffekte im Bereich von einigen hundert Milligray, die ursächlich mit Herz- |
Epidemiologische Studien | Für ischämische Herzerkrankungen nach akuter Strahlenexposition ergab die LSS Evidenz für eine Dosis- Für zerebrovaskuläre Erkrankungen nach akuter Strahlenexposition ergab die LSS Evidenz für eine Schwelle im Bereich von einigen hundert Milligray, Die Studien zu Herz- |
Anhang
Tabelle A.1: Überblick der Zuordnungen der Herz-Kreislauferkrankungen zu Codes im ICD-9 und ICD-10 (WHO)
ICD- | ICD- | |
Akutes rheumatisches Fieber | 390- | 100- |
Chronische rheumatische Herzkrankheiten | 393- | 105- |
Hypertonie (Hochdruckkrankheit) | 401- | 110- |
Ischämische Herzkrankheiten | 410- | 120- |
Pulmonale Herzkrankheit und Krankheiten des Lungenkreislaufs | 415- | 126- |
Sonstige Formen der Herzkrankheit | 420- | 130- |
Zerebrovaskuläre Krankheiten | 430- | 160- |
Krankheiten der Arterien, Arteriolen und Kapillaren | 440- | 170- |
Krankheiten der Venen, der Lymphgefäße und der Lymphknoten, anderenorts nicht klassifiziert | 451- | 180- |
Sonstige und nicht näher bezeichnete Krankheiten des Kreislaufsystems | 195- |
Abbildungsnachweis
Abbildung 2.1: | Alters- und geschlechtsspezifische Sterblichkeit an Herz- |
Abbildung 3.1: | Schematische Darstellung der gesunden Wand einer menschlichen muskulären Arterie (a), der schrittweisen Entstehung einer arteriosklerotischen Läsion (b und c, Erläuterung siehe unten) sowie der Läsionsruptur und Thrombusbildung (d). Die Verwendung der Abbildung erfolgte mit freundlicher Genehmigung von Macmillan Publishers LTD: Peter Libby et al.: Progress and challenges in translating the biology of atherosclerosis. Nature 473, 317 – 325, 19 May 2011, doi:10.1038/nature10146, Published online, 18 May 2011 (http:// |
Abbildung 4.1: | In Tierversuchen am ApoE- |
Abbildung 5.1: | Analyse der LSS- |
Abbildung 5.2: | Analyse der LSS- |
Tabellennachweis
Tabelle 2.1: | Orientierende Einteilung kardiovaskulärer Risikofaktoren (nach Grundy et al. 1999). |
Tabelle 5.1: | Übersicht über veröffentlichte und im Bericht verwendete epidemiologische Studien zu strahlenassoziierten Risiken für Herz- |
Tabelle 5.2: | Ergebnisse für das ERR je Dosis in der Analyse von Daten zu Herz- |
Tabelle 5.3: | Ergebnisse für das ERR je Dosis in der Analyse von Daten zu ischämischen Herzerkrankungen mit dem linearen Dosis- |
Tabelle 5.4: | Ergebnisse für das ERR je Dosis in der Analyse von Daten zu zerebrovaskulären Erkrankungen mit dem linearen Dosis- |
Tabelle 6.1: | Evidenz eines Zusammenhangs von Herz- |
Tabelle A.1: | Überblick der Zuordnungen der Herz- |
1 Es wurden 3 252 ischämische Herzerkrankungen (ICD9 410-414) registriert. Nach Aussage der Autoren gab es Fehler bei der Zuordnung der Herzerkrankungen zu den einzelnen Untertypen, wie z. B. ischämischen Herzerkrankungen. Da die Autoren die Ergebnisse für alle Herzerkrankungen (ICD9 390-398, 402, 404, 410-429) für verlässlicher halten, werden von dieser Arbeit die Ergebnisse für alle Herzerkrankungen verwendet.
